
在某一化学反应中,反应物A的浓度在15 s内从3.0 mol/L变成1.5 mol/L,
在这15 s内A的化学反应速率为( )
A.1.5 mol/(L·s) B.1.5 mol/L
C.0.1 mol/(L·s) D.0.1 mol/L
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
设C+CO2===2CO(正反应为吸热反应),反应速率为v1;N2+3H2===2NH3(正反应为放热反应),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备
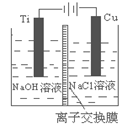 纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
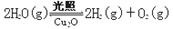 ⊿H >0
⊿H >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃、1.01×105 Pa时,下列哪个反应放出的热量能表示乙炔的燃烧热 ( )
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g)
B.C2H2(g)+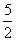 O2(g)===2CO2(g)+H2O(l)
O2(g)===2CO2(g)+H2O(l)
C.C2H2(g)+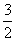 O2(g)===2CO(g)+H2O(g)
O2(g)===2CO(g)+H2O(g)
D.C2H2(g)+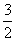 O2(g)===2CO(g)+H2O(l)
O2(g)===2CO(g)+H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
相同体积、相同氢离子浓度的强酸溶液和弱酸溶液分别跟足量的镁完全反
应,下列说法正确的是( )
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较 两者产生氢气的量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g)⇌C(g),平衡时C 的体积分数为40%.
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 ,C的体积分数为 .
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40%,则该密闭容器体积为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com