
【题目】ClO2又称百毒净,可用于水的净化和纸浆、纺织品的漂白。用如下图所示装置(夹持装置和加热装置省略)制备ClO2并探究ClO2的某些性质。
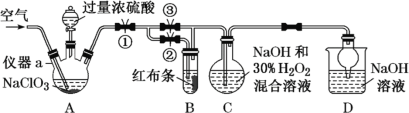
已知:①高氯酸:沸点90 ℃,浓度低于60%比较稳定,浓度高于60%遇含碳化合物易爆炸。
②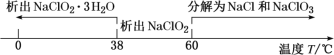
回答下列问题:
(1)仪器a的名称为_______。实验开始前,胶塞及导管接口必须包锡箔纸,其原因是__________。
(2)写出装置A制备ClO2同时生成高氯酸的化学方程式:___________。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间,装置C中生成NaClO2,离子方程式为______。若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______。
(4)从装置C反应后的溶液中获得NaClO2晶体,常采用减压蒸发结晶。采用减压蒸发的原因是______,减压蒸发时,当有较多晶体析出时,再_____(填操作方法),洗涤,干燥。即可得NaClO2。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠替代Cl2。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,NaClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是________。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样量取V0mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用cmol·L1Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1mL。
已知:2ClO2+10I+8H+=2Cl+5I2+4H2O,2Na2S2O3+I2=Na2S4O6+2NaI,计算该ClO2的浓度为________g/L(用含字母的代数式表示,计算结果化简)。
【答案】三颈烧瓶 橡胶是含碳化合物,若生成的高氯酸浓度高时遇胶塞及导管口易发生爆炸 3NaClO3+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O 2ClO2+2OH-+H2O2=2![]() +2H2O+O2 红布条褪色 减压可降低沸点,较低温度下蒸发,避免晶体高温分解 在38~60 ℃温度下,趁热过滤 NaClO2>Cl2>Na2FeO4
+2H2O+O2 红布条褪色 减压可降低沸点,较低温度下蒸发,避免晶体高温分解 在38~60 ℃温度下,趁热过滤 NaClO2>Cl2>Na2FeO4 ![]()
【解析】
A装置由过量浓硫酸和NaClO3反应制备ClO2和高氯酸,反应为:3NaClO3+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O,高氯酸遇含碳化合物易爆炸,故胶塞及导管接口必须包锡箔纸,关闭止水夹②,打开止水夹①③,通空气一段时间,ClO2与NaOH和H2O2在C中反应:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2,控制温度38 ℃~60℃下进行减压蒸发结晶可得晶体NaClO2,关闭止水夹③,打开止水夹②,ClO2有强氧化性,使B中红布条褪色,用D中NaOH溶液吸收尾气,据此分析作答。
(1)仪器a为三颈烧瓶;由题可知,高氯酸浓度高于60%遇含碳化合物易爆炸,橡胶是含碳化合物,若生成的高氯酸浓度高时遇胶塞及导管易发生爆炸;
(2)A中由过量浓硫酸和NaClO3反应制备ClO2和高氯酸,反应为:3NaClO3+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;
(3)关闭止水夹②,打开止水夹①③,ClO2与NaOH和H2O2在C中反应:2ClO2+2OH-+H2O2=2![]() +2H2O+O2,若关闭止水夹③,打开止水夹②,ClO2有强氧化性,使B中红布条褪色;
+2H2O+O2,若关闭止水夹③,打开止水夹②,ClO2有强氧化性,使B中红布条褪色;
(4)根据已知,温度低于38℃,得到的晶体含有结晶水,温度高于60℃NaClO2会分解,故从装置C反应后的溶液中获得NaClO2晶体,需控温在38℃60℃进行减压蒸发结晶,采用减压蒸发的原因是减压可降低沸点,较低温度下蒸发,避免晶体高温分解;
(5)NaClO2中氯元素由+3价降为1价,则1molNaClO2转移电子4mol,消毒效率为![]() ,1molNa2FeO4转移电子3mol,消毒效率可表示为
,1molNa2FeO4转移电子3mol,消毒效率可表示为![]() ,1molCl2转移电子2mol,消毒效率可表示为:
,1molCl2转移电子2mol,消毒效率可表示为:![]() ,三种消毒杀菌剂的消毒效率由大到小的顺序是NaClO2>Cl2>Na2FeO4;
,三种消毒杀菌剂的消毒效率由大到小的顺序是NaClO2>Cl2>Na2FeO4;
(6)设原ClO2溶液的浓度为x,
![]()
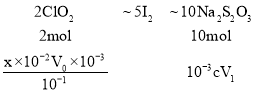
x=![]() mol/L=
mol/L=![]() g/L。
g/L。


科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾的化学 K3[Fe(C2O4)3]·3H2O 可用于制作工程图中“晒制蓝图”时的感光剂。
(1)钾离子最外层电子的轨道表示式 _________。
(2)已知草酸氢钾(KHC2O4)溶液中c(C2O42—)>c(H2C2O4),则该溶液呈性________(填酸、碱、中),并简述原因_________,写出HC2O4—水解的离子方程式_________________。
为探究三草酸合铁酸钾受热分解的产物,按下图进行实验。
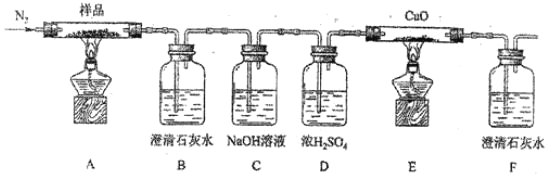
(3)实验开始时,先要通一会氮气,其目的是__________。
(4)实验中观察到装置 B、F 中澄清石灰水均变浑浊,装置 E 中固体变为红色, 由此判断热分解产物中一定含有_________、_________。
(5)样品完全分解后,装置 A 中的残留物含有 FeO 和 Fe2O3,检验 Fe2O3 存在的方法是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代的物质文明华夏民族在认识、改造和应用物质方面有着辉煌的历史。
①东晋《抱扑子》中记载:“以曾青涂铁,铁赤色如铜”(“曾青”即硫酸铜溶液)。
②战国《周礼》中记载;“煤饼烧砺房成灰”(“砺房”即牡砺壳,主要成分是碳酸钙)。将“灰”溶于水可制得沤浸树皮脱胶的碱液。
③元代《庚道集》中记载:“点铜戍银”(即单质铜与砷融合形成银白色的物质)
请运用你学过的化学知识回答下列问题;
(1)在①~③中,发生了化学变化的是___(填编号)其中发生分解反应的化学方程式为___。
(2)①中发生变化的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
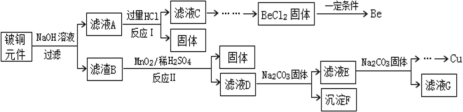
已知:I、铍、铝元素化学性质相似;BeCl2熔融时能微弱电离;
Ⅱ、常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10—20 | 4.0×10—38 | 2.1×10—13 |
(1)滤液A的主要成分除NaOH外,还有___________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中获得BeCl2的晶体易带结晶水,但是将BeCl2晶体与SOCl2(易水解,产物之一能使品红褪色)混合可得无水BeCl2,请从平衡移动角度解释原因:__________。
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:______。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.0080mol·L-1、c(Mn2+)=0.010mol·L-1,缓慢通氨气调节pH可将其依次分离(体积变化忽略不计)。当Cu2+恰好完全沉淀(c(Cu2+)=1.0×10-5 mol·L-1)时,溶液中c(Cu2+)/ c(Fe3+)约为______。(![]() ≈4.7,保留两位有效数字)
≈4.7,保留两位有效数字)
(5)电解NaCl-BeCl2混合熔盐可制备金属铍。
①电解过程中,加入氯化钠的目的是________。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为________。已知部分物质的熔沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A. B.
B. C.
C. D.
D.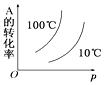
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下Kw=10-13,在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,下列说法正确的是( )
A. 若所得混合液为中性,且a=12,b=2,则Va∶Vb=1∶1
B. 若所得混合液为中性,且a+b=12,则Va∶Vb=100∶1
C. 若所得混合液pH=10,且a=12,b=2,则Va∶Vb=1∶9
D. 若所得混合液pH=10,且a=12,b=2,则Va∶Vb=101∶99
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,v(A)=________,v(B)=________。
(2)化学方程式中,x=________,y=________,p=________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.可用水来确定某氧化钠粉末中是否含有过氧化钠
B.可用二氧化碳来确定某氧化钠粉末中是否含有过氧化钠
C.可利用在空气中加热的方法除去氧化钠中的过氧化钠
D.将足量的过氧化钠、氧化钠分别加到酚酞溶液中,最终溶液均为红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com