
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.常温常压下,11.2 L二氧化硫气体中含有0.5NA个SO2分子
B.标准状况下,22.4 L CCl4中含有NA个分子
C.常温常压下,10.6g Na2CO3含有的Na+离子数为0.2 NA
D.将NA个HCl气体分子溶于1L水中得到1mol·L-1的盐酸
科目:高中化学 来源: 题型:
【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)根据第②个实验可以确定存在的离子是_______;
(2)除(1)中确定存在的离子以外,还一定存在的离子是__________,可能存在的离子是______;
(3)第③个实验中沉淀减少的原因是(用离子方程式表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及金属材料在生产、生活中有广泛的应用。
(1)我省多地开展文明城市创建工作,垃圾分类回收是一项重要举措。某市街道垃圾桶如图所示,请回答下列问题:

①图中标识的物质,属于金属材料的是__________(写出一种即可)。
②使用铝合金做内筒的优点是____ (写出一点即可)。某品牌饮料的空易拉罐应收入_____(填“可回收”或“不可回收”)筒中。
③铁制品锈蚀的过程,实际上是铁跟空气中的________发生化学反应的过程:除去铁制品表面的铁锈可用稀盐酸,反应的化学方程式为________________________________
(2)将甲、乙、丙三种金属分别投入稀硫酸中,甲、丙表面有气泡产生,乙无明显现象:若将甲放入丙的硫酸盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顺序是________________。
(3)将一定质量的铁粉加到Al(NO3)3、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列说法正确的是________ (垃字母)。
A.若滤液为蓝色,则滤渣中一定有银,可能有铜
B.若滤液中含有银、铜、铁,则滤液中一定含有Al3+、Fe3+、NO3-
C.若滤液为浅绿色,则滤渣中一定含银、铜、铝
D.若滤渣中加稀盐酸无气泡产生,则滤液中一定有Al3+、Fe2+、Cu2+,可能有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
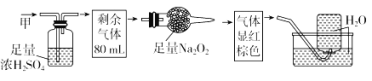
A. NH3、NO2、N2B. NH3、NO、CO2
C. NH3、NO2、CO2D. NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中盐酸的用途十分广泛,常用来制备气体。
(1)某小组同学欲配制230mL0.4mol/L盐酸,则需取用4mol/L盐酸___mL,实验中需要用到的玻璃仪器有____、___、量筒、烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是____。
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.量取溶液时,仰视刻度线
E.装入试剂瓶时,有少量溶液溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42—可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

下列叙述正确的是( )
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O 4e– = O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
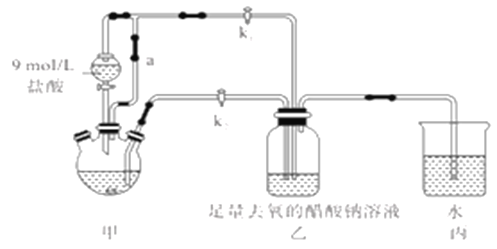
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com