
【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)根据第②个实验可以确定存在的离子是_______;
(2)除(1)中确定存在的离子以外,还一定存在的离子是__________,可能存在的离子是______;
(3)第③个实验中沉淀减少的原因是(用离子方程式表示)______________。
【答案】NH4+ SO42-、K+、CO32- Cl- BaCO3+2H+=Ba2++CO2↑+H2O
【解析】
第一份加入AgNO3溶液有沉淀产生,不能说明原溶液中一定含有Cl-,因为CO32-、SO42-、OH-都能与Ag+反应生成沉淀;第二份加入足量NaOH溶液加热后,收集到气体,该气体为NH3,则原溶液中一定含有NH4+,即n(NH4+)=n(NH3)=0.04mol;第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,该沉淀可能是是BaSO4也可能是BaCO3也可能是两者混合物,经足量盐酸洗涤后,沉淀质量为2.33g,最后得到沉淀是BaSO4,即n(BaSO4)=![]() =0.01mol,6.27g沉淀中除含有BaSO4外,还含有BaCO3,n[Ba(CO3)2]=
=0.01mol,6.27g沉淀中除含有BaSO4外,还含有BaCO3,n[Ba(CO3)2]=![]() =0.02mol,则原溶液中一定含有SO42-和CO32-。且物质的量分别是0.01mol、0.02mol,则原溶液一定不含有H+和Ba2+,NH4+所带电荷的物质的量为0.04mol,阴离子所带电荷物质的量为0.06mol,溶液显电中性,因此原溶液中一定含有K+,可能含有Cl-。
=0.02mol,则原溶液中一定含有SO42-和CO32-。且物质的量分别是0.01mol、0.02mol,则原溶液一定不含有H+和Ba2+,NH4+所带电荷的物质的量为0.04mol,阴离子所带电荷物质的量为0.06mol,溶液显电中性,因此原溶液中一定含有K+,可能含有Cl-。
(1)根据上述分析,第②个实验可以确定存在的离子是NH4+;
(2)原溶液中一定含有的离子除NH4+外,还含有CO32-、SO42-、K+;可能存在的离子是Cl-;
(3)加入足量的氯化钡溶液,得到沉淀是BaCO3和BaSO4,BaSO4不溶于盐酸,BaCO3能与盐酸反应,发生BaCO3+2H+=Ba2++CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的有
① 3 mol单质Fe完全转化为Fe3O4,失去9NA个电子
② 标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
③ 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
④常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
⑤ 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
⑥浓硫酸(含1molH2SO4)与足量Cu加热发生反应生成0.5NA个SO2分子
⑦标准状况下,22.4 L N2和H2的混合气休中含有NA个原子
⑧23gNa与足量H2O反应完全后可生成NA个氢气分子
A. 一项B. 两项C. 三项D. 四项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项的编号和曲线的编号一一对应,其中描述错误的是
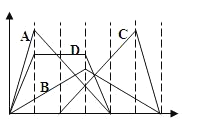
A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用来解释下列事实的离子方程式正确的是
A.钢铁发生吸氧腐蚀的正极反应:O2+4e—+2H2O=4OH—
B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe(OH)3+3H2O
C.用铜为电极电解饱和食盐水:2Cl—+2H2O![]() Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
D.碳酸氢钠溶液中加入过量石灰水:HCO3—+OH—=CO32—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如图所示:
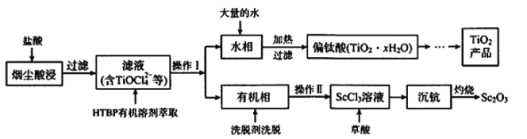
(1)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为_____。
(2)“水相”的主要离子有TiOCl42-、H+、Cl-及Mg2+,写出加入大量的水并加热发生的相关离子反应方程式_____。
(3)酸浸过程中,稍过量的盐酸的作用除溶解吸收烟尘外,另外还有的作用是_______。
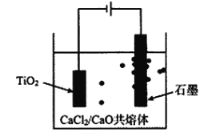
(4)钛的冶炼新法是剑桥电解法(如图)。以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。利用中学所学知识可以预测CaCl2的作用包含增强导电性及______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素(H2NCONH2)的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置产生的电能对乙装罝进行铁上镀铜的实验,下列说法中不正确的是

甲 乙
A.H+透过质子交换膜由左向右移动
B.M电极反应式:H2NCONH2+H2O—6e—=CO2↑+N2↑+6H+
C.铁电极应与X相连接
D.当N电极消耗0.5mol气体时,则铁电极增重32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g)![]() 2SO3(g) △H= -197 kJ/mol。开始时在10 L的密闭容器中加入4.0 molSO2(g)和10.0 molO2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=_________,升高温度K将_____________(增大、减小或不变)。
2SO3(g) △H= -197 kJ/mol。开始时在10 L的密闭容器中加入4.0 molSO2(g)和10.0 molO2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=_________,升高温度K将_____________(增大、减小或不变)。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是__________________(填字母)。
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是__________________(填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 ____________(填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 ____________(填字母)。

A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
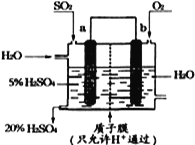
(4)某实验小组设想如右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:___________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:① 2SO2(g)+O2(g)![]() 2SO3(g)△H1= —197 kJ/mol;② H2O(g)=H2O(l)△H2= —44 kJ/mol;③ 2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3= —545 kJ/mol。写出SO3(g)与H2O(l)反应的热化学方程式是_____________________________。
2SO3(g)△H1= —197 kJ/mol;② H2O(g)=H2O(l)△H2= —44 kJ/mol;③ 2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3= —545 kJ/mol。写出SO3(g)与H2O(l)反应的热化学方程式是_____________________________。
(6)由硫酸可制得硫酸盐,在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比___________________________。 (已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)= 5.2×10-9。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.常温常压下,11.2 L二氧化硫气体中含有0.5NA个SO2分子
B.标准状况下,22.4 L CCl4中含有NA个分子
C.常温常压下,10.6g Na2CO3含有的Na+离子数为0.2 NA
D.将NA个HCl气体分子溶于1L水中得到1mol·L-1的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com