
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的有
① 3 mol单质Fe完全转化为Fe3O4,失去9NA个电子
② 标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
③ 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
④常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
⑤ 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
⑥浓硫酸(含1molH2SO4)与足量Cu加热发生反应生成0.5NA个SO2分子
⑦标准状况下,22.4 L N2和H2的混合气休中含有NA个原子
⑧23gNa与足量H2O反应完全后可生成NA个氢气分子
A. 一项B. 两项C. 三项D. 四项
【答案】A
【解析】
①Fe3O4中铁元素的化合价为+![]() ,因此3mol单质铁完全转化成Fe3O4,失去电子物质的量为3mol×(
,因此3mol单质铁完全转化成Fe3O4,失去电子物质的量为3mol×(![]() -0)=8mol,故①不正确;
-0)=8mol,故①不正确;
②氯气溶于水,只有少量的Cl2与水发生反应,氯元素存在的形式为Cl2、Cl-、ClO-、HClO,故②不正确;
③1molS8中含有共价键的物质的量为8mol,则32gS8中含有共价键的物质的量为![]() =1mol,故③正确;
=1mol,故③正确;
④常温下铁和浓硝酸发生钝化反应,产生致密的氧化薄膜阻碍反应的进行,故④不正确;
⑤碳元素在溶液存在形式有CO32-、HCO3-、H2CO3,根据物料守恒,得出n(CO32-)+n(HCO3-)+n(H2CO3)=1L×0.1mol·L-1=0.1mol,故⑤不正确;
⑥Cu是足量,随着反应的进行,硫酸的浓度逐步降低,反应将会停止,生成SO2的物质的量小于0.1mol,故⑥不正确;
⑦无论氮气还是氢气,都是双原子分子,标准状况下,22.4L的该混合气体中含有2mol原子,故⑦不正确;
⑧Na与H2O发生:2Na+2H2O=2NaOH+H2↑,23gNa与足量水完全反应后,生成氢气的物质的量为![]() =0.5mol,故⑧不正确;
=0.5mol,故⑧不正确;
综上所述选项A正确;
答案为A。


科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是常见的无色液体,B是海水中最多的盐,D、F、J均为气体,C是石灰乳,L是石灰石,M具有漂白性,G、K均具有磁性,其中K为常见的金属单质。
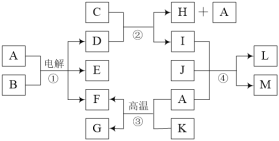
(1)E的化学式为____。
(2)A的电子式为____。
(3)写出反应③的化学方程式:____。
(4)写出反应④的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有pH=2的HX溶液和HY溶液各1mL ,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是
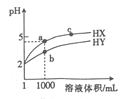
A. a、c两点对应HX的电离平衡常数:K(c)>K(a)
B. a、b两点对应的溶液中:c(X-)>c(Y-)
C. 等物质的量浓度的NaX和NaY的混合溶液中:c(HY)>c(HX)
D. 分别向10mL0.1mol/LHX溶液和10mL 0.1mol/L HY溶液中滴加同浓度的氢氧化钠溶液至pH = 7,消耗氢氧化钠溶液较少的是HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8 mol /L和5.4 mol /L,在一定的条件下它们反应生成NH3,10 min后测得N2的浓度是0.8 mol /L,则在这10 min内用NH3来表示的平均反应速率是
A.0.1 mol /(L·min)B.0.2 mol /(L·min)
C.0.3 mol /(L·min)D.0.6 mol /(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________(填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________。
②已知:25 ℃时有关物质的溶度积
物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq)![]() Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关。
完成下列填空:
(1)可用来衡量一个国家石油化工发展水平的是__________的产量。
A.乙烷 B.乙烯 C.甲烷
(2)乙烯能使溴水褪色,说明乙烯能发生__________反应。
A.取代 B.加成 C.氧化还原
(3)甲烷和氯气在光照条件下能发生反应,反应的其中一个方程式如下:
CH4 + Cl2 → CH3Cl + HCl ,该反应属于__________反应。
A.取代 B.加成 C.氧化还原
(4)下列与异戊烷如图,互为同分异构体的是(_______)
![]()
A.  B.
B.![]() C.
C.
(5)聚乙烯安全无毒,可用于生产食品包装袋。聚乙烯的结构简式为(_______)
A.CH2=CH2 B.![]() C.
C. ![]()
(6)同系物结构相似,在分子组成上相差一个或若干个CH2原子团,请写出任意一个甲烷的同系物的结构简式。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)根据第②个实验可以确定存在的离子是_______;
(2)除(1)中确定存在的离子以外,还一定存在的离子是__________,可能存在的离子是______;
(3)第③个实验中沉淀减少的原因是(用离子方程式表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及金属材料在生产、生活中有广泛的应用。
(1)我省多地开展文明城市创建工作,垃圾分类回收是一项重要举措。某市街道垃圾桶如图所示,请回答下列问题:

①图中标识的物质,属于金属材料的是__________(写出一种即可)。
②使用铝合金做内筒的优点是____ (写出一点即可)。某品牌饮料的空易拉罐应收入_____(填“可回收”或“不可回收”)筒中。
③铁制品锈蚀的过程,实际上是铁跟空气中的________发生化学反应的过程:除去铁制品表面的铁锈可用稀盐酸,反应的化学方程式为________________________________
(2)将甲、乙、丙三种金属分别投入稀硫酸中,甲、丙表面有气泡产生,乙无明显现象:若将甲放入丙的硫酸盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顺序是________________。
(3)将一定质量的铁粉加到Al(NO3)3、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列说法正确的是________ (垃字母)。
A.若滤液为蓝色,则滤渣中一定有银,可能有铜
B.若滤液中含有银、铜、铁,则滤液中一定含有Al3+、Fe3+、NO3-
C.若滤液为浅绿色,则滤渣中一定含银、铜、铝
D.若滤渣中加稀盐酸无气泡产生,则滤液中一定有Al3+、Fe2+、Cu2+,可能有Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com