
����Ŀ��CuCl���л��ϳɵ���Ҫ���������������ϡ������ȹ�ҵ����ҵ���ɷ�ͭ�ϣ���Fe��Al���仯���SiO2���ʣ�������CuCl�Ĺ����������£�
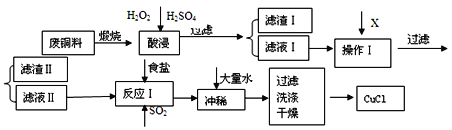
���� | ��ʼ���� | ������ȫ |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 5.6 | 6.7 |
Al(OH)3 | 3.8 | 4.7 |
��֪��CuCl����NaCl��Ũ��Һ������CuCl2-��CuCl2-����Һ��ˮϡ�ͺ������CuCl������
��1�����յ���ҪĿ������______________________________________��
��2��������Ϊ������Һ��pHֵ����ΧΪ___________�����������X������_________________________ ��
A.CuO B.Cu(OH)2 C .NaOH ��Һ D.CaCO3
��3������I����Ҫ�ɷ���________�����������Ҫ�ɷ���_________��
��4������Һ���м���ʳ�β�ͨ��SO2������CuCl����д����Ӧ�����ӷ���ʽ________________________________________________________________________________________ ��
��5���ڷ�Ӧ���У����Ȳ�ʹ��ŨNaC1��Һ����ҪĿ����_____________________________________________________________________________________ ��
���𰸡� ʹͭת��Ϊ��������������� 4.7��pH<5.6 ABC SiO2 Fe(OH)3��Al(OH)3 2H2O+2Cu2++SO2+4C1-==2CuCl2-+4H++SO42- �ӿ�CuCl2-���������ʲ���������
����������ͭ��(��Fe��Al���仯���SiO2����)����CuCl�����շ�ͭ�ϣ���ͭת��Ϊ�������������ټ�����������ϡ���ᣬ�������費�ܣ��������ӽ�����Һ�����ˣ���������Ϊ�������裬��Һ��Ϊ�����ӡ������ӡ�ͭ���ӵ���Һ������Һ�м���X�õ�������ӦΪ�������ӡ������ӳ��ӣ���X��ΪCuO��Cu(OH)2��Cu2(OH)2CO3��Cu������pH4.7��5.6�����������ӡ������ӣ�������Ϊ����������������������Һ��Ϊͭ���ӵ���Һ������ʳ�β�ͨ��SO2������Ӧ��2H2O+2Cu2++SO2+4Cl-=2CuCl2-+SO42-+4H+������CuCl2-��CuCl2-����Һ��ˮϡ�ͺ������CuCl���������ˡ�ϴ�ӡ�����õ���Ʒ��
(1)ͭ��ϡ�����Ӧ�����յ���ҪĿ����ʹͭת��Ϊ���������������ʴ�Ϊ��ʹͭת��Ϊ��������������
(2)����X���ᷴӦ����pHʹ���������Ӻ���������ȫ��������ͭ���Ӳ��ܳ������ɱ������ݿ�֪��������Ҫ����pH�ķ�ΧΪ4.7��pH��5.6��CuO��Cu(OH)2��NaOH��Һ�����Ժ��ᷴӦ��̼��������ᷴӦ�����������ˮ������ʹ����ȫ��Ӧ����ѡABC���ʴ�Ϊ��4.7��pH��5.6��ABC��
(3)��������������������Ϊ�������裬���������Ҫ�ɷ���Fe(OH)3��Al(OH)3���ʴ�Ϊ��SiO2��Fe(OH)3��Al(OH)3��
(4)���������л�ԭ�ԣ�ͭ�����������ԣ����Զ��������ͭ���ӷ���������ԭ��Ӧ����Ӧ����ʽΪ2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+���ʴ�Ϊ��2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+��
(5)�����¶Ȼ�����Ӧ���Ũ���ܼӿ췴Ӧ���ʣ������¶�����70��80�棬��ʹ��NaClŨ��Һ��Ŀ�������CuCl2-���������ʲ��������ʣ��ʴ�Ϊ�����CuCl2-���������ʲ��������ʡ�


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧѧϰ�˻�ѧ��Ӧ���ʺ����뵽����H2O2�Ʊ���������������������ʵ�鷽��������ʵ��̽����
ʵ���� | �� Ӧ �� | �� �� �� |
�� | �Թ��м���3 mL 2�� H2O2��Һ��3������ˮ | �� |
�� | �Թ��м���3 mL 5�� H2O2��Һ��3������ˮ | �� |
�� | �Թ��м���3 mL 5�� H2O2��Һ��3������ˮ | 1 mL 0.1 mol/L FeCl3��Һ |
�� | �Թ��м���3 mL 5�� H2O2��Һ��3��ϡ������Һ | 1 mL 0.1 mol/L FeCl3��Һ |
�� | �Թ��м���3 mL 5�� H2O2��Һ��3��NaOH��Һ | 1 mL 0.1 mol/L FeCl3��Һ |
���������ϡ���������(H2O2)����ˮ��Һ�׳�˫��ˮ����������һ����ɫҺ�壬���ʱȽ��ȶ����ڼ��ȵ������£����ֽܷ������������о������������Ƶ�5����H2O2��Һ���ȵ�65��ʱ���������ų������ȵ�80��ʱ���н϶�����������
��1������ʵ�鷢����Ӧ�Ļ�ѧ����ʽΪ ��
��2��ʵ���ʵ���ҵ�ʵ��Ŀ���� ��
ʵ�����ʵ�鶡��ʵ�����ʵ��Ŀ���� ��
��3������ݸ�ͬѧ���ĵ����Ϸ���H2O2�����ʣ�����ʵ���ʵ�����ܷ�ﵽʵ��Ŀ�ģ� ��
��4��ʵ������и�ͬѧ��ʵ������������в�������������ռ�������2������6��ʱ����ע������������ж�������¼�������±���
ʱ�䣯s | 20 | 40 | 60 | 80 | 100 | 120 | |
���������mL | ʵ��� | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
ʵ�鶡 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
ʵ���� | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
����ʵ���죬0��20 s�ķ�Ӧ����v1�� mL/s��100��120 s�ķ�Ӧ����v2�� mL/s��
������ʵ��������������ʴ��ڲ������Ҫԭ���� ��
������ͼ�Ǹ���ʵ���ռ���������������ʱ����ʱ����Ƶ�ͼ������c��ʾ����ʵ�� (������������������������)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ���ҵ�����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2) �ڴ����������ºϳɼ״�������������Ӧ����:
��CO(g)+2H2(g) ![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=-58kJ/mol
CH3OH(g)+H2O(g) ��H=-58kJ/mol
��CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H=+41kJ/mol
CO(g)+H2O(g) ��H=+41kJ/mol
�ش���������:
(1)��֪��Ӧ���е���صĻ�ѧ��������������:
��ѧ�� | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | a | b | c | d | x |
��x=______�����ú�������ĸ�Ĵ���ʽ��ʾ��
(2)����lmolCO2��2molH2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�ڡ����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ��
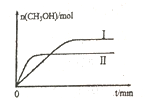
�����ߢ��Ӧ��ƽ�ⳣ����С��ϵΪK��_____K��(�>��=����<��)
��һ���¶���,���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����______��
a.������ѹǿ����
b.�״���ˮ����������ȱ��ֲ���
c.v��(H2)=3v��(CH3OH)
d.2��C=O���ѵ�ͬʱ��3��H-H�γ�
����5min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ_____�����¶��µ�ƽ�ⳣ��Ϊ_____���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���____��
a.�����¶� b.ʹ�ú��ʵĴ��� c.����He d.��ԭ�����ٳ���CO2��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��пͭԭ���װ����ͼ��ʾ�����������ӽ���Ĥֻ���������Ӻ�ˮ����ͨ���������й�������ȷ���ǣ������� 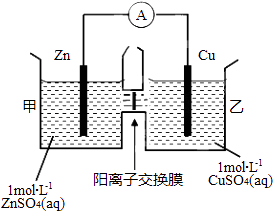
A.ͭ�缫�Ϸ���������Ӧ
B.��ع���һ��ʱ��׳ص�c��SO42������С
C.��ع���һ��ʱ����ҳ���Һ������������
D.�������ӷֱ�ͨ������Ĥ���������ƶ���������Һ�е��ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС������ͼ1װ�ã��г�װ���ԣ��ռ�ij���Ѿ���SO2 �� ���Ժ������вⶨ�� 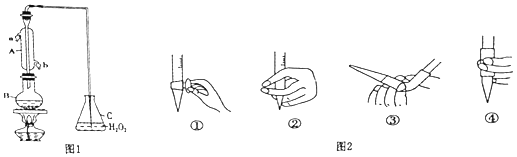
��1������A�������� ��
��2��B�м���300.00mL���Ѿƺ��������ᣬ����ʹSO2ȫ���ݳ�����C��H2O2��ȫ��Ӧ���仯ѧ����ʽΪ ��
��3����ȥC�й�����H2O2 �� Ȼ����0.0900mol/LNaOH����Һ���еζ����ζ�ǰ������ʱ��Ӧѡ��ͼ2�е� ��
��4�����ζ��յ�ʱ��Һ��pH=8.8����ѡ���ָʾ��Ϊ ��
��5���òⶨ���������ʵ��ֵƫ�ߣ����������ڲ����Լ���������ģ����ܵ�ԭ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״�ټ��ء�Ѫ�쵰��Ҷ�����к��е�����Ԫ�������ǣ� ��
A. I��Mg��Fe B. Cu��Mg��I
C. I��Fe��Mg D. Fe��Mg��I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ��Ϊԭ�Ϻϳɼ״����й��Ȼ�ѧ����ʽ���£�
��2CH4(g)+O2(g)==2CO(g)+4H2(g) ��H1=-70.8kJmol-1
��CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
��2CH4(g)+O2(g)![]() 2CH3OH(g) ��H3=-251.0 kJmol-1
2CH3OH(g) ��H3=-251.0 kJmol-1
��1����Ӧ������H2=________kJmol-1��
��2��������ɱ���ܱ�������Ͷ��1 mol CO��2 mol H2���ڲ�ͬ�����·�����Ӧ��CO(g)+2H2(g)![]() CH3OH(g)��ʵ����ƽ��ʱCH3OH�����ʵ������¶ȡ�ѹǿ�仯��ͼ1��ʾ��
CH3OH(g)��ʵ����ƽ��ʱCH3OH�����ʵ������¶ȡ�ѹǿ�仯��ͼ1��ʾ��

��M ��ʱ��H2 ��ת����Ϊ_________��ѹǿ�� p1_______���>����<����=����p2��
����Ӧ������N ��v��(CO) _______���>����<����=����M ��v ��(CO)
����ѹǿΪp1����1L�����ܱ������н���������Ӧ����ʼͶ�ϲ��䣩���ڲ�ͬ�¶���������Ӧ��ƽ�ⳣ���Ķ���(IgK)��ͼ2��ʾ�����¶�Ϊ506Kʱ��ƽ�ⳣ��K=____________�� B��C��D��E�ĵ�������ȷ��ʾ�÷�Ӧ��1gK ��T�Ĺ�ϵ�ĵ�Ϊ________________��
������2L�����ܱ������г���x (x>0)mol H2��2 mol CO����8 mol CH3OH(g)���� 506 K�½���������Ӧ��Ϊ��ʹ�÷�Ӧ������У�x�ķ�ΧΪ________________��
��3��ij�״�-����ȼ�ϵ����KOH��ҺΪ�������Һ����KOHȫ��ת����KHCO3ʱֹͣ�ŵ���д����ʱ�����ĵ缫��Ӧʽ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����۲���ȷ����(����)
ʵ����� | ���� | ���� | |
A | ����Ƶε�����Ƭ�� | ����Ƭ���� | ��������Ԫ�ر��� |
B | ���Ҵ��������ظ������Һ��� | ��ɫ��Һ��Ϊ��ɫ | �Ҵ����л�ԭ�� |
C | �����Ƶ�������ͭ����������Һ��ϼ��� | ����ש��ɫ���� | �����Ǿ��л�ԭ�� |
D | ��ʯ���ͼ�ǿ�Ȳ���������ͨ��������Ȼ�̼��Һ�� | ��Һ��ɫ | ���ﲻ�������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ������� 
A.��ͼ 1 ��ʾ����ͭ�к��������������γ�ԭ��أ���ͭ������
B.��ͼ 2 ��ʾ������ 0.1 mol ����ת��ʱ���� 0.1 mol Cu2O ����
C.������ɫ��ѧ������Ƶ���ȡ Cu2O �ĵ�����ͼ 2 ��ʾ��ͭ�缫������ԭ��Ӧ
D.��ͼ 3 ��ʾ��װ���з��� Cu+2Fe3+�TCu2++2Fe2+�ķ�Ӧ���� X ���Ǹ�����Y ���IJ��Ͽ� ����ͭ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com