
某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是 。
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 | 铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 | Fe +2H+= H2↑+ Fe2+ | Fe具有还原性 |
| ② | 氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 | | |
| ③ | 氯化亚铁溶液加 入锌片 | | Fe2++ Zn =" Fe" + Zn 2++ | |
| ④ | | | | Fe3+具有氧化性 |
(2)试管 (1分)
(3)②2Fe2+ +Cl2=2Fe3+ +2 Cl-(1分)、Fe3++3SCN- = Fe(KSCN)3(1分);Fe2+具有还原性(1分)
③ Fe2+具有氧化性(1分)
④在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片);(1分)
加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失(1分)。
(或先加入足量Cu片(或铁粉或锌片),再加入KSCN溶液,无血红色出现);
2Fe3+ +Cu = 2Fe2+ + Cu2+ 或2Fe3+ +Fe = 3Fe2+或2Fe3+ + Zn = 2Fe2+ + Zn 2+或
2Fe3+ + 3Zn = 2Fe+3 Zn 2+(1分)
(4)AD (2分)
(5)氯化亚铁溶液中的Fe2+被氧化(2分);配制氯化亚铁溶液时要加入少量的铁粉(2分)。
(6)C(2分)
解析试题分析:(2)还缺反应容器:试管。
(3)②加入氯水后,Cl2把Fe2+氧化为Fe3+,离子方程式为:2Fe2+ +Cl2=2Fe3+ +2 Cl-,Fe3+与SCN?发生络合反应:Fe3++3SCN- = Fe(KSCN)3,说明Fe2+具有还原性。
③Fe2++ Zn =" Fe" + Zn 2+反应中,Fe元素的化合价降低,说明Fe2+具有氧化性。
④要证明Fe3+具有氧化性,先加入KSCN溶液,溶液变红,再加入还原剂,如Cu片(或铁粉或锌片),红色消失,说明Fe3+具有氧化性,根据选择的试剂写出离子方程式。
(4)元素化合价处于中间价态的物质,既有氧化性也有还原性,Cl2、H2O2中Cl元素和O元素处于中间价态,这两种物质既有氧化性也有还原性,故A项、D项正确。
(5)在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,是因为Fe2+具有还原性,被氧化为Fe3+;配制氯化亚铁溶液时加入少量的铁粉,可防止Fe2+被氧化。
(6)Fe2+具有还原性,可使KMnO4溶液褪色,故C项正确。
考点:本题考查实验仪器的选择、离子的检验、离子方程式的书写、实验方案的设计与分析、 物质氧化性和还原性的判断。


科目:高中化学 来源: 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暧,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C+___K2Cr2O7+___—___CO2↑+ ___K2SO4+ ___Cr2(SO4)3+___H2O
①完成并配平上述化学方程式。
②在上述方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式________
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为_____________________。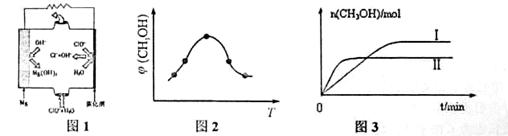
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K_______。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数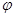 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。
③在同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线 I、II对应的平衡常数大小关系为KI_______KII(填“>”、“<”或“ = ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是______________________________。
(2)B中溶液发生反应的离子方程式是______________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是________________________________________。
(4)过程Ⅲ实验的目的是__________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐 ,得电子能力逐渐______。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。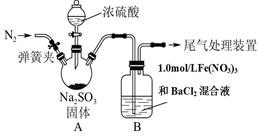
请回答:
(1)装置A中用于添加浓硫酸的仪器名称为 。
(2)实验前鼓入N2的目的是 。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是 。
②按观点2,装置B中反应的离子方程式是 ,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号) 。
| A.1 mol/L稀硝酸 |
| B.1.5 mol/L Fe(NO3)2溶液 |
| C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
| D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I—能被NO3-离子氧化成IO3-离子,被H2O2或O2等氧化成I2;②IO3-离子能被HSO3-离子还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3-中的哪一种。
限选试剂如下:1.0 mol?L-1HNO3溶液、1.0 mol?L-1 H2SO4溶液、1.0 mol?L-1NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2 ;
假设2:该食盐样品中含I—
假设3: 。
Ⅱ.设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡。 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中不正确的是 ( )
| A.向滴有酚酞的水中加入过量Na2O2粉末并振荡,溶液由无色变红又变无色 |
| B.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应是一个放热反应且有氧气生成 |
| C.Na2O2与H2O反应是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂 |
| D.Na2O2与H2O反应是一个置换反应,有单质O2产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
海水提镁的主要流程如下: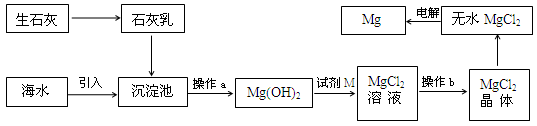
下列说法正确的是
①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤电解熔融MgCl2比电解熔融的MgO制金属镁更节约能量
| A.①②③④⑤ | B.②③ | C.④⑤ | D.①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,w克某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w克。在①H2 、②CO、 ③CO和H2的混合气、④C6H12O6中( )
| A.均不符合 | B.只有①② | C.只有①②③ | D.全部符合 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应所得溶液中一定只含一种溶质的是
| A.向AlCl3溶液中滴入NaOH溶液 | B.向NaOH溶液中通入SO2气体 |
| C.向稀硝酸中加入过量铁粉 | D.向Na2CO3溶液中滴入盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com