
| A. | 银氨溶液、浓溴水 | B. | 酸性高锰酸钾溶液、氯化铁溶液 | ||
| C. | 酸性高锰酸钾溶液、浓溴水 | D. | 氯化铁溶液、浓溴水 |
分析 乙烯含有C=C键,能发生加成反应和氧化反应;乙苯不溶于水,能使酸性高锰酸钾褪色;乙酸乙酯能发生水解;苯酚与溴水发生取代反应生成三溴苯酚,能发生显色反应,据此分析解答.
解答 解:A.浓溴水和乙酸乙酯、乙苯不反应,现象相同,不能鉴别,故A不选;
B.酸性高锰酸钾溶液能氧化乙苯、己烯、苯酚而导致酸性高锰酸钾溶液褪色,现象相同,不能鉴别,故B错误;
C.溴水能鉴别己烯、苯酚,现象分别是褪色和生成白色沉淀三溴苯酚,酸性高锰酸钾溶液能与甲苯发生氧化还原反应而褪色,与乙酸乙酯不反应,故C正确;
D.氯化铁溶液能鉴别苯酚,现象是溶液变为紫色,溴水能鉴别己烯、苯酚,现象分别是褪色和生成白色沉淀三溴苯酚,但不能鉴别乙苯和乙酸乙酯,故D错误;
故选C.
点评 本题考查有机物鉴别,为高频考点,明确物质性质的特殊性是解本题关键,难点是利用物质差异性选取合适的检验试剂,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | HI、H2、I2的浓度相等且不再改变时 | B. | 混合气体的颜色深浅不再变化时 | ||
| C. | 混合气体的平均摩尔质量不变时 | D. | v(HI):v(H2):v(I2)=2:1:1时 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 1molZn与足量的该硫酸反应产生2g氢气 | |
| C. | 配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
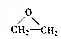 称为环氧乙烷,它在一定条件下,能与氢氧化物发生加成反应,氢原子加到氧原子上,其他部分加在碳原子上,下列对环氧乙烷的衍生物
称为环氧乙烷,它在一定条件下,能与氢氧化物发生加成反应,氢原子加到氧原子上,其他部分加在碳原子上,下列对环氧乙烷的衍生物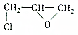 的叙述正确的是( )
的叙述正确的是( )| A. | 能与水反应生成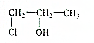 | |
| B. | 能碱性水解生成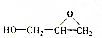 | |
| C. | 在一定条件下可以合成甘油 | |
| D. | 加入AgNO3溶液能生成难溶于硝酸的白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1mol HCl 500mL | B. | 含36.5g HCl 500mL | ||
| C. | 2mol•L-1 HCl 500mL | D. | 2mol•L-1 H2SO4 250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL含9.5g MgCl2的溶液 | |
| B. | 31g Na2O溶于水配成1L溶液 | |
| C. | 4%的H2SO4溶液(ρ=1.025g•cm-3) | |
| D. | 213mL 0.5mol•L-1盐酸和82mL 0.5mol•L-1盐酸的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com