
【题目】滴定法不仅适合于酸碱中和滴定,还可以用于氧化还原滴定和沉淀滴定。
I. 甲同学根据反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,进行测定H2C2O4溶液的物质的量浓度的实验。实验步骤如下:
①取待测H2C2O4溶液25.00 mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1 mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00 mL。请回答:
(1)滴定时,将KMnO4溶液装在 __________(填“酸式”或“碱式”)滴定管中。
(2)滴定过程中眼睛注视 __________。
(3)计算H2C2O4溶液的物质的量浓度为 ________mol/L。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 _________(填字母代))。
A 滴定终点读数时俯视 B 取用待测液的滴定管水洗后未用待测液润洗
C 锥形瓶水洗后未干燥 D 装标准液的滴定管尖嘴部分有气泡,滴定后消失
II. 已知:
AgCl | AgBr | AgSCN | Ag2CrO4 | AgCN | |
溶解度(mol/L) | 1.34×10-6 | 7.1×10-7 | 1.0×10-6 | 6.5×10-5 | 1.1×10-8 |
颜色 | 白 | 淡黄 | 白 | 砖红 | 白 |
(5)①乙同学参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是_______(填字母代号)。
a CaCl2 b NaBr c NaCN d K2CrO4
②滴定达终点的现象是___________。
【答案】酸式 锥形瓶内溶液颜色的变化 0.2 D d 滴入最后一滴溶液,生成砖红色沉淀,且半分钟内不变色
【解析】
I⑴滴定时,将KMnO4具有强氧化性。
⑵滴定过程中眼睛注视锥形瓶内溶液颜色的变化。
⑶根据高锰酸钾与草酸的关系式计算草酸的物质的量,再计算H2C2O4溶液的物质的量浓度。
⑷A. 滴定终点读数时俯视,读出消耗标液减少,误差偏低;B. 取用待测液的滴定管水洗后未用待测液润洗,待测液物质的量减少,消耗标液体积减少,误差偏低;C. 锥形瓶水洗后未干燥,对结果无影响;D. 装标准液的滴定管尖嘴部分有气泡,滴定后消失,读出标液偏高,误差偏高。
II. ⑸①硝酸银标准溶液滴定氯离子含量时,指示剂应当选择溶解度比氯化银溶解度大且有明显颜色的。
②滴定达终点的现象是滴入最后一滴溶液,生成砖红色沉淀,且半分钟内不变色。
I⑴滴定时,将KMnO4具有强氧化性,因此溶液装在酸式滴定管中;故答案为:酸式。
⑵滴定过程中眼睛注视锥形瓶内溶液颜色的变化,故答案为;锥形瓶内溶液颜色的变化。
⑶根据方程式比例关系:2KMnO4 — 5H2C2O4,草酸的物质的量![]() ,则H2C2O4溶液的物质的量浓度
,则H2C2O4溶液的物质的量浓度![]() ;故答案为:0.2。
;故答案为:0.2。
⑷A. 滴定终点读数时俯视,读出消耗标液减少,误差偏低,故A不符合题意;B. 取用待测液的滴定管水洗后未用待测液润洗,待测液物质的量减少,消耗标液体积减少,误差偏低,故B不符合题意;C. 锥形瓶水洗后未干燥,对结果无影响,故C不符合题意;D. 装标准液的滴定管尖嘴部分有气泡,滴定后消失,读出标液偏高,误差偏高,故D符合题意;综上所述,答案为D。
II. ⑸①硝酸银标准溶液滴定氯离子含量时,指示剂应当选择溶解度比氯化银溶解度大且有明显颜色的,Ag2CrO4沉淀符合,因此作指示剂的是K2CrO4;故答案为:d。
②滴定达终点的现象是滴入最后一滴溶液,生成砖红色沉淀,且半分钟内不变色;故答案为:滴入最后一滴溶液,生成砖红色沉淀,且半分钟内不变色。


科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,工业制备硫酸的接触室中二氧化硫不能完全转化为三氧化硫,尾气必须处理。某兴趣小组模拟接触室中反应,如图是分别在三种不同实验条件下进行反应,反应物二氧化硫的浓度随时间的变化。
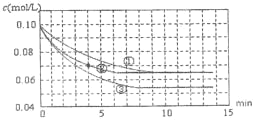
(1)工业制硫酸的接触室中用二氧化硫与氧气制三氧化硫的生产条件为_______。
(2)实验②,0~4min 平均反应速率v(O2)=______。
(3)实验③可能改变的条件是什么:______请简述理由。______(已知正反应放热)
(4)二氧化硫尾气可以用氨水吸收,最终的产物可能有(NH4)2SO4、(NH4)2SO3、NH4HSO3。若三者的物质的量浓度相同时,铵根离子浓度由大到小的顺序为______。
(5)浓硫酸是常见的干燥剂,请解释不能干燥硫化氢与氨气的原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中按照下表甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g) ![]() 2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
N2(mol) | H2(mol) | NH3(mol) | |
甲 | 1 | 3 | 0 |
乙 | 0.5 | 1.5 | 1 |
丙 | 0 | 0 | 4 |
A.乙容器中反应向逆向进行
B.达到平衡时,甲、乙、丙三容器中NH3体积分数的大小顺序:甲=乙>丙
C.乙中的NH3转化率为40%
D.若丙在恒温恒压的密闭容器进行,平衡后往容器中再充入4 mol NH3,重新达到平衡时,体系中NH3体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置分别进行实验,请回答下列问题:
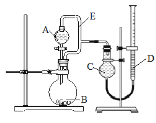
实验 | A中试剂 | B中试剂 | C中液体 |
I | 饱和食盐水 | 电石 | H2O |
II | 浓氨水 | NaOH固体 | CCl4 |
III | 生铁 | H2O | |
IV | NaOH溶液 | 镁铝合金 | H2O |
(1)导管E的作用是:____________________、_________________;
(2)实验I烧瓶B中发生反应的化学方程式是________,产生的气体经验纯后点燃,现象是___________;
(3)实验Ⅱ剩余的NH3需吸收处理。以下各种尾气吸收装置中,不能防止倒吸的是___________;

(4)实验III的实验目的是验证生铁在潮湿空气中会发生吸氧腐蚀。则A中试剂可选用__________(填序号);
a NaOH溶液 b C2H5OH c NaCl溶液 d 稀硫酸
能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_________;
(5)写出实验IV中发生反应的离子方程式_________;若读数时C管液面低于D管液面,则测出的镁铝合金中镁的质量分数将_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~G是几种烃分子的球棍模型,据此回答下列问题:
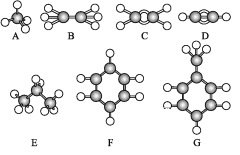
(1)上述七种烃中:
①常温下含碳量最高的气态烃是____(填结构简式)。
②能够发生加成反应的烃有____种。
③与A互为同系物的是____(填对应字母)。
④一卤代物种类最多的是____(填对应字母)。
(2)写出C发生加聚反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.热的纯碱溶液去油污效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
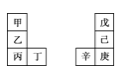
A.丙与庚的原子序数相差3
B.气态氢化物的热稳定性:戊>己>庚
C.乙所在周期元素中,其简单离子的半径最大
D.常温下甲的单质在水中反应要比乙剧烈很多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及部分重要化合物的相互转化如图所示。
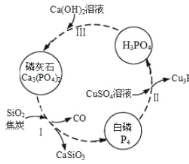
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com