
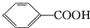
 >H2C03>
>H2C03>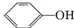 ,将
,将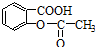 转变为
转变为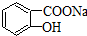 的方法有( )
的方法有( )| A、①② | B、①③ | C、②③ | D、① |
 转变为
转变为 ,可先发生碱性条件的水解,再由酸性的强弱可知,水解产物中通入足量的CO2即可,以此来解答.
,可先发生碱性条件的水解,再由酸性的强弱可知,水解产物中通入足量的CO2即可,以此来解答. >H2CO3>
>H2CO3> ,则再通入足量的CO2生成邻羟基苯甲酸钠,故A正确;
,则再通入足量的CO2生成邻羟基苯甲酸钠,故A正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用规格为20mL的量筒一次量取16mL溶液,比用规格为10mL的量筒分两次量取16mL溶液的误差小 |
| B、受热后的蒸发皿要用坩锅钳夹取,并放在石棉网上冷却 |
| C、过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 |
| D、配制一定物质的量浓度溶液时,为了避免溶质的损失,直接把称量的固体溶质转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CCl4 |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
| A、①② | B、③④ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A、分子式为C17H23O3 |
| B、该有机物难溶于水 |
| C、该有机物跟FeCl3溶液作用显紫色 |
| D、1mol该物质最多可与2mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NaOH+H2SO4═Na2SO4+2H2O |
| B、Fe+H2SO4═FeSO4+H2↑ |
| C、BaCl2+H2SO4═BaSO4↓+2HCl |
| D、H2+CuO═Cu+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com