
【题目】下列金属分别与盐酸反应,其离子方程式正确的是( )
A.Na+2H+=Na++H2↑B.Al+2H+=Al3++H2↑
C.2Fe+6H+=2Fe3++3H2↑D.Mg+2H+=Mg2++H2↑
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】已知在一定条件下,2molH2完全燃烧生成液态水时放出热量572kJ,请回答下列问题
(1)反应物的总能量_____(填“大于”、“小于”或“等于”)生成物的总能量:
(2)在此条件下,若反应生成含1molO-H键的液态水,则放出热量为____kJ;若2mol氢气完全燃烧生成水蒸气,则放出的热量____(填“>”、“<”或“=”)572kJ;
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两电极均由多孔的碳块组成,_______(填正、负)极通入H2,____(填正、负)极通入O2;

(4)某化学兴趣小组对上述新型装置进行了适度改造,将在a电极通入的氢气改为乙炔(C2H2),请写出改造后a电极发生反应的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
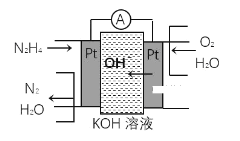
【题目】(1)肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,肼燃料电池原理如图所示,通入N2H4的电极上发生的电极反应式为______。
(2)在2L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为____。
②用O2表示从0~2 s内该反应的平均速率v=_____。
③如图所示,表示NO2变化曲线的是_____。
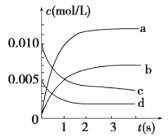
④能说明该反应已达到平衡状态的是_____(填序号)。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是
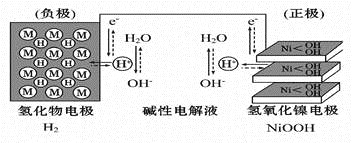
A. 放电时电池内部H+向负极移动
B. 充电时,将电池的负极与外接电源的正极相连
C. 充电时阳极反应为Ni(OH)2+ OH-- e-=NiOOH+H2O
D. 放电时负极的电极反应式为MHn-ne-= M+nH+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和A1(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如下:

(1)反应中副产品a是______(用化学式表示);
(2)升高pH至4.0~4.5的目的是______;
(3)生产过程中可循环使用的物质是______(用化学式表示);
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用______(填编号);
a.NaOHb.Alc.氨水d.A12O3e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[A12(OH)nCl6-nH2O]m,实验室为测定n的值,进行如下操作:
①称取ag晶体,制成粉末,加热至质量不再变化时,得到bg。此过程可能用到的下列仪器有______;
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取ag晶体:用A试剂溶解→加足量AgNO3溶液→进行C操作→洗涤、烘干→称量为cg。则试剂A为______(填操作名称),C操作为______(填操作名称)。最后综合推算出n的值_____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①CH4 ②CH3CH2OH ③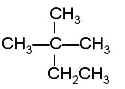 ④癸烷 ⑤CH3COOH ⑥
④癸烷 ⑤CH3COOH ⑥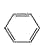 ⑦
⑦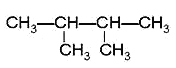 ⑧
⑧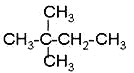 ⑨丙烷
⑨丙烷
请根据上述给出的物质按要求回答下列问题:
(1)分子中含有14个氢原子的烷烃的分子式是____;
(2)与③互为同分异构体的是_____(填序号);
(3)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是____(填序号);它与⑧互为_____关系;
(4)相对分子质量为44的烷烃的结构简式为______;
(5)用“>”表示①③④⑨熔沸点高低顺序:______(填序号);
(6)具有特殊气味,常作萃取剂的有机物在铁作催化剂的条件下与液溴发生一取代反应的化学方程式_____;
(7)有机物②在加热条件下和CuO反应的化学方程式_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
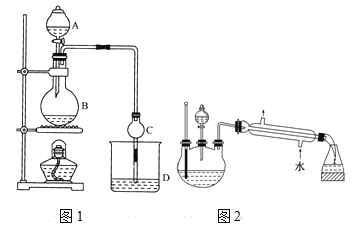
请回答:
(1)浓硫酸的作用是____;用同位素18O示踪法确定反应产物水分子中氧原子的提供者,若用18O标记乙醇分子中的氧原子,请写出该化学方程式:________。
(2)球形干燥管C的作用是_______。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是_______。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出________;再加入无水硫酸钠除去水,然后进行________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)________。
(6)该实验中用30g乙酸与46g乙醇反应,如果实际得到的乙酸乙酯的质量是26.4g,则该实验中乙酸乙酯的产率是______。(产率指的是某种生成物的实际产量与理论产量的比值。已知乙醇、乙酸、乙酸乙酯的相对分子质量分别为:46、60、88)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由Fe2+变为Fe3+若榨汁时加入维生素C,可有效防止这种现象的发生这说明维生素C具有()
A.还原性B.氧化性C.碱性D.酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com