
【题目】锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为:
A. 0.25 mol B. 0.5 mol C. 1 mol D. 2 mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关锂、钠、钾、铷、铯说法不正确的是( )
A. 核电荷数依次增大
B. 最外层电子数依次增多
C. 核外电子层数依次增多
D. 原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是
A. SO2可用于杀菌、消毒
B. 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的
C. 碘是人体必需微量元素,所以要多吃富含髙碘酸的食物
D. 海水淡化的方法主要有蒸馏法、电解法、离子交换法等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
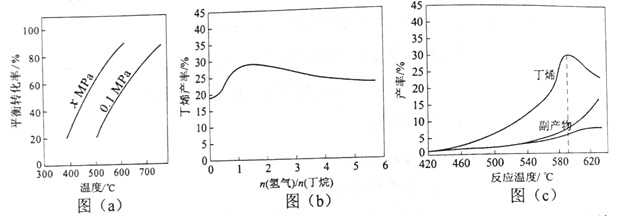
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是
A. F2、K、HCl B. Cl2、Al、H2
C. NO2、Na、Br2 D. O2、SO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g) ![]() CH3OH(g) △H2
CH3OH(g) △H2
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。

(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1____0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2____0,△S____0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值____________(写出计算过程及结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的反应方程式为: 2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2,其构造如图所示。有
关说法不正确的是

A. 负极反应式:Zn+2OH--2e-=Zn(OH)2
B. 放电时正极MnO2得到电子,发生氧化反应
C. 该电池使用一段时间后,电解液pH增大
D. 放电时,锌粉失去的电子,从负极通过外电路流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 酒越陈越香与酯化反应有关
B. 乙烷、丙烷和丁烷都没有同分异构体
C. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D. 甲烷与足量氯气在光照下反应可生成难溶于水的油状液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com