
【题目】下列解释事实的离子方程式不正确的是( )
A.水玻璃中滴入酚酞呈红色:SiO32-+2H2O ![]() H2SiO3+2OH-
H2SiO3+2OH-
B.Ba(NO3)2溶液中通入过量SO2:3SO2+ 3Ba2++ 2NO3- + 2H2O= 3BaSO4↓ + 2NO↑ + 4H+
C.NH4Al(SO4)2溶液中滴入过量NaOH溶液:NH4++Al3++5OH-=Al(OH)4- +NH3·H2O
D.AgNO3溶液中滴入足量氨水中:Ag++2NH3·H2O=Ag(NH3)2++2H2O
【答案】B
【解析】
A.水玻璃是Na2SiO3的水溶液,H2SiO3是弱酸,SiO32-会水解,且水解呈碱性,故滴入酚酞呈红色,A正确;
B.SO2过量,Ba2+和NO3-,将按1:2反应完,离子方程式为:3SO2+ Ba2++ 2NO3- + 2H2O= BaSO4↓ + 2NO↑ +2SO42-+ 4H+,B错误;
C.NH4Al(SO4)2溶液中滴入过量NaOH溶液,NH4+和Al3+均反应完,且Al3+转化为:Al(OH)4- ,离子方程式为:NH4++Al3++5OH-=Al(OH)4- +NH3·H2O,C正确;
D. AgNO3溶液中滴入足量氨水生成络合离子Ag(NH3)2+,离子方程式为:Ag++2NH3·H2O=Ag(NH3)2++2H2O,D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式为
 ,它属于
,它属于
A. 芳香烃B. 易溶于水的有机物C. 苯甲酸的同系物D. 高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法不正确的是
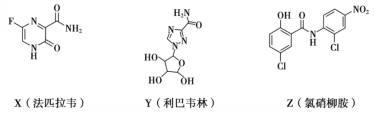
A.X的分子式为C5H4O2N3F
B.Z中含有6种官能团
C.Y和Z都有羟基,但性质不完全相同
D.X和Z都能发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚 乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性。以下是我国化学家 近年来合成的聚乙炔衍生物分子 M 的结构式及 M 在稀硫酸作用下的水解过程。
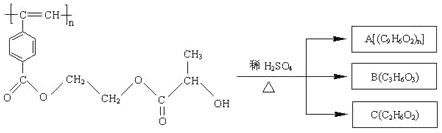
下列有关说法中不正确的是
A. M 与 A 均能使酸性高锰酸钾溶液和溴水褪色
B. B 中含有两种官能团,B 能发生消去反应和缩聚反应
C. A、B、C 各 1 mol 分别不足量金属钠反应,放出的气体的物质的量之比为 1∶2∶2
D. 1 mol M 与热的烧碱溶液反应,可消耗 2n mol 的 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化锰![]() 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入![]() 溶液,充分反应后加入
溶液,充分反应后加入![]() 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入![]() 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
|
|
| |
初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤I中:
①Fe2+浓度降,滤渣中存在![]() 。结合离子方程式解释原因:_______。
。结合离子方程式解释原因:_______。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______。
(3)步骤II中:
①![]() 酸性溶液的作用:_______。
酸性溶液的作用:_______。
②结合离子方程式说明MnCO3的作用: _______。
(4)步骤III通入H2S后, Ni2+不达标而![]() 达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
(5)测定无水![]() 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量![]() ,使
,使![]() 氧化为
氧化为![]() 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵![]() 滴定
滴定![]() ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①样品中MnCl2的质量分数是_____(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的![]() 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原 料,可用作止痛剂、退热剂、防腐剂和染料中间体。乙酰苯胺的制备原理为:
![]() +CH3COOH
+CH3COOH![]() +H2O
+H2O

注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。

实验步骤:
步骤 1:在圆底烧瓶中加入无水苯胺 9.2 mL,冰醋酸 17.4 mL,锌粉0.1 g,安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制在105℃ 左右,反应约 60~80 min,反应生成的水及少量醋酸被蒸出。 步骤 2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有 100 mL 冰 水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰 苯胺粗品。步骤 3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤 1 中所选圆底烧瓶的最佳规格是_________(填序号)。
a.25 mL b.50 mL c.150 mL d.200 mL
(2)实验中加入少量锌粉的目的是___________________________________________________________________________。
(3)从化学平衡的角度分析,控制分馏柱上端的温度在 105℃左右的原因____________________________________________________________________________。
(4)洗涤乙酰苯胺粗品最合适的方法是_____(填序号)。
a.用少量冷水洗 b.用少量热水洗 c.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、
_______________、过滤、洗涤、干燥(选则正确的操作并排序)。
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品 8.1g,则乙酰苯胺的产率是______________ %。
(7)如图的装置有 1 处错误,请指出错误之处____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是( )
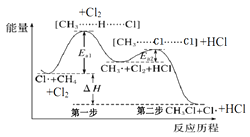
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是( )
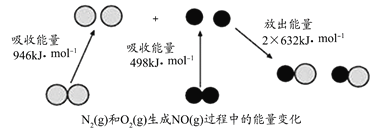
A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)反应吸收的能量为180kJ
D.1molN2(g)和1molO2(g)具有的总能量大于2molNO(g)具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q原子序数依次增大。已知:X的最外层电子数是次外层的2倍,在地壳中Z的含量最大,W是短周期元素中原子半径最大的主族元素,Q的最外层比次外层少2个电子。请回答下列问题:
(1)X的价层电子排布式是___,Q的原子结构示意图是____。
(2)Y、Z两种元素中,第一电离能较大的是(填元素符号)_____,原因是______。
(3)Z、W、Q三种元素的简单离子的半径从小到大排列的是________。
(4)关于Y、Z、Q三种元素的下列有关说法,正确有是_______;
A.Y的轨道表示式是:
B.Z、Q两种元素的简单氢化物的稳定性较强的是Z
C. Z、Q两种元素简单氢化物的沸点较高的是Q
D.Y常见单质中σ键与π键的数目之比是1:2
(5)Q与Z形成的化合物QZ2,中心原子Q的杂化类型是_____,QZ2易溶于水的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com