
【题目】无水氯化锰![]() 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入![]() 溶液,充分反应后加入
溶液,充分反应后加入![]() 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入![]() 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
|
|
| |
初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤I中:
①Fe2+浓度降,滤渣中存在![]() 。结合离子方程式解释原因:_______。
。结合离子方程式解释原因:_______。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______。
(3)步骤II中:
①![]() 酸性溶液的作用:_______。
酸性溶液的作用:_______。
②结合离子方程式说明MnCO3的作用: _______。
(4)步骤III通入H2S后, Ni2+不达标而![]() 达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
(5)测定无水![]() 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量![]() ,使
,使![]() 氧化为
氧化为![]() 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵![]() 滴定
滴定![]() ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①样品中MnCl2的质量分数是_____(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的![]() 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
【答案】Mn + 2HCl = MnCl2 + H2↑ 空气中的O2 将部分Fe2+氧化为Fe(OH)3沉淀,相关的离子方程式为:4Fe2+ + O2 + 10H2O = 4Fe(OH)3↓+ 8H+ Pb2+ + Mn = Pb + Mn2+ 将剩余Fe2+氧化为Fe3+,调节pH使Fe3+转化为Fe(OH)3沉淀除去 MnCO3+2H+=Mn2++H2O+CO2↑,Fe3++3H2O![]() Fe(OH)3+3H+ <
Fe(OH)3+3H+ < ![]() 偏高
偏高
【解析】
制备无水氯化锰的原料是含有Fe,Ni,Pb等金属杂质的粗锰粉,因此制备过程中要将Fe,Ni,Pb等杂质元素去除;第一步将粗锰粉加酸溶解,Fe溶解后产生Fe2+,由于其还原性较强,容易被氧气氧化;由于金属活动性Mn>Fe>Ni>Pb,所以溶液中Pb2+会与未反应完全的Mn反应,造成Pb2+浓度下降;第二步加入过氧化氢,主要是为了将Fe2+氧化为Fe3+,便于沉淀法去除;第三步通入H2S,是想通过生成硫化物沉淀的方式去除残余的Zn2+和Pb2+,由于Pb的去除达标,而Zn的仍未达标,所以PbS的溶解度应该更低。
(1)Mn与盐酸反应的化学方程式为:![]() ;
;
(2)①将粗锰粉酸浸后,Fe单质转化为还原性较强的Fe2+,静置一段时间,Fe2+会被空气中的氧气氧化,进而生成Fe(OH)3沉淀,相应的离子方程式为:![]() ;
;
②由于金属活动性Mn>Fe>Ni>Pb,所以溶液中Pb2+会与未反应完全的Mn反应,造成Pb2+浓度下降,因此与之相关的反应为:![]() ;
;
(3)①通过分析可知,过氧化氢的作用是将溶液中的Fe2+氧化为Fe3+,便于调节pH值将其转化为Fe(OH)3沉淀除去;
②通过分析可知,MnCO3的作用即调节溶液的pH值以便于Fe3+沉淀,相关的离子方程式为:![]() 以及
以及![]() ;
;
(4)通过分析可知,PbS的溶解度更小;
(5)①由题可知,ag无水氯化锰中的Mn2+经过氧化后全部转变为Mn3+,硫酸亚铁铵与Mn3+反应时,Mn3+和Fe2+按照1:1反应,所以MnCl2的质量分数为: ;
;
②若不加热,溶液中剩余的硝酸铵会在酸性条件下体现氧化性能与硫酸亚铁铵发生反应,这样会使消耗的硫酸亚铁铵偏大,那么最终求出的纯度也偏大。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E 五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②空间充填模型 |
B | ① 由 C、H 两种元素组成;②空间充填模型为 |
C | ① 由 C、H、O 三种元素组成;②能与 Na 反应,但不能与 NaOH 溶液反应;③ 能与 E 反应生成酯 |
D | ① 相对分子质量比 C 少 2;②能由 C 氧化而成 |
E | ① 由 C、H、O 三种元素组成;②球棍模型为 |
回答下列问题:
(1)A 在一定条件下发生聚合反应生成的高分子化合物的名称为_____。
(2)A 与氢气发生加成反应后生成 F,与 F 在分子组成和结构上相似的有机物有很多,它们均符合通式CnH2n+2(n为正整数)。当 n=_____时,这类有机物开始出现同分异构体。
(3)B 具有的性质是_____(填序号)。
①无色无味液体 ②密度比水的大 ③难溶于水 ④有毒 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥在一定条件下可与氢气反应
(4)在铁作用下,B 与液溴反应的化学方程式为_____。
(5)C能与E反应生成 酯 ,该反应的反应类型为_________; 其化学方程式为_______。
(6)由C氧化生成D 的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用一定浓度NaOH溶液滴定某醋酸溶液,混合溶液的导电能力变化曲线如图所示,其中b点为恰好反应点。下列说法不正确的是
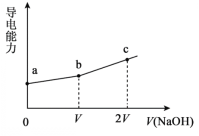
A.溶液的导电能力与离子种类和浓度有关
B.b点溶液的pH=7
C.a→c过程中,n(CH3COO-)不断增大
D.c点的混合溶液中,c(Na+)>c(OH)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某加碘食盐中是否含有KIO3,取相同食盐样品进行下表所示实验:
(已知:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O)
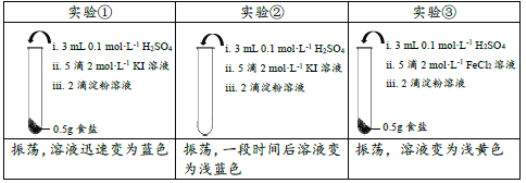
下列说法中不正确的是( )
A.仅由实验①不能证明食盐样品中存在KIO3
B.实验②中发生反应的离子方程式为4I-+O2+4H+=2I2+2H2O
C.实验③溶液变黄色是生成了Fe3+,证明食盐样品中存在KIO3
D.结合实验①和②的现象差异,可以推断实验样品中存在KIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是( )
A.水玻璃中滴入酚酞呈红色:SiO32-+2H2O ![]() H2SiO3+2OH-
H2SiO3+2OH-
B.Ba(NO3)2溶液中通入过量SO2:3SO2+ 3Ba2++ 2NO3- + 2H2O= 3BaSO4↓ + 2NO↑ + 4H+
C.NH4Al(SO4)2溶液中滴入过量NaOH溶液:NH4++Al3++5OH-=Al(OH)4- +NH3·H2O
D.AgNO3溶液中滴入足量氨水中:Ag++2NH3·H2O=Ag(NH3)2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:[Cu(NH3)4]SO4易溶于水,难溶于酒精。溶液中存在平衡:I.![]()
![]()
![]() 和II.铜离子的水解平衡。下列说法不正确的是( )
和II.铜离子的水解平衡。下列说法不正确的是( )
A.[Cu(NH3)4]SO4可通过CuSO4溶液与过量氨水作用得到,其水溶液呈碱性
B.加热[Cu(NH3)4]SO4溶液,上述平衡I正向移动,Cu2+浓度增大
C.加热浓缩[Cu(NH3)4]SO4溶液,再冷却结晶,获得产品中混有CuSO4晶体
D.向[Cu(NH3)4]SO4溶液中,缓慢逐滴加入乙醇,可析出大颗粒[Cu(NH3)4]SO4晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示A、B、C、D、E五种仪器:
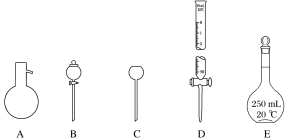
(1)请将仪器名称,填入相应的横线上:
A__________B_______C_________D______E_______。
(2)上述A~E五种仪器中,使用前必须检漏的是______,组装气体发生器必须液封的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
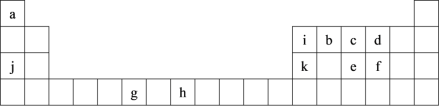
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式______,h2+中未成对电子数为____。
(2)在b2a2分子中,元素b为__杂化,该分子是___分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为____。
(3)bd2与bf2比较,沸点较高的是___(填分子式),原因是_______。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是___。
A h位于元素周期表中第四周期第VIII族,属于d区元素
B e的基态原子中,3p能级为半充满,属于p区元素
C 最外层电子排布式为4s2,一定属于IIA族
D 最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)i元素最高价含氧酸是一元弱酸,它的水溶液之所以呈弱酸性并非本身能电离出H+,而是它加合了一个OH-,形成配位键,请用“→”表示);请用离子方程式表示____与ia4-互为等电子体的一种阳离是____,ia4-的空间构型为___。
(6)下表是一些气态原子逐级电离能(kJ·mol-1):

①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量___________
②表中X可能为以上元素中的____元素(填写元素符号)。Y与X的最高价氧化物的水化物溶液反应的离子方程式为______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com