
【题目】25℃时,用一定浓度NaOH溶液滴定某醋酸溶液,混合溶液的导电能力变化曲线如图所示,其中b点为恰好反应点。下列说法不正确的是
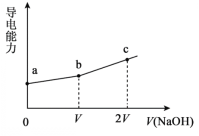
A.溶液的导电能力与离子种类和浓度有关
B.b点溶液的pH=7
C.a→c过程中,n(CH3COO-)不断增大
D.c点的混合溶液中,c(Na+)>c(OH)>c(CH3COO-)
【答案】B
【解析】
A.不同离子所带电荷量不同,导电能力不同;同种离子,浓度不同,导电能力也不同,A项正确;
B.由题可知,b点为恰好反应点,即滴定终点,此时溶液可视为醋酸钠的水溶液,由于醋酸根水解,所以溶液显碱性,常温下,pH>7,B项错误;
C.a到b的过程,醋酸与加入的NaOH发生中和反应,醋酸的解离平衡正向移动,n(CH3COO-)逐渐增大;b到c的过程,由于溶液中NaOH的量逐渐增加,导致CH3COO-的水解平衡逆向移动,n(CH3COO-)逐渐增大;因此,从a到c的过程,n(CH3COO-)不断增大,C项正确;
D.由题可知,c点的溶液可视为等浓度的NaOH与CH3COONa的混合溶液,由于醋酸根会发生水解,所以溶液中有:c(Na+)>c(OH-)>c(CH3COO-),D项正确;
答案选B。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】已知2H2(g)+CO(g)![]() CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
A.因该反应为放热反应,故不加热就可发生
B.相同条件下,2 mol H2的能量或1 mol CO 的能量一定高于1 mol CH3OH的能量
C.相同条件下,反应物2 mol H2和1 mol CO 的总能量一定高于生成物1 mol CH3OH(g)的总能量
D.达到平衡时,CO的浓度与CH3OH的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如下:
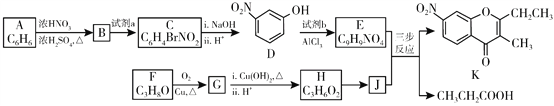
已知: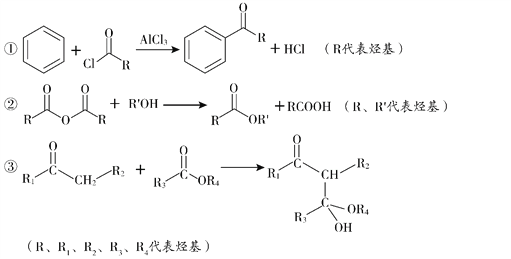
(1)A的结构简式是_________;根据系统命名法,F的名称是__________。
(2)B→C所需试剂a是__________;试剂b的结构简式是_________。
(3)C与足量的NaOH反应的化学方程式为__________。
(4)G与新制Cu(OH)2反应的化学方程式为__________。
(5)已知:①2H![]() J+H2O;②J的核磁共振氢谱只有两组峰。以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:________。
J+H2O;②J的核磁共振氢谱只有两组峰。以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:________。
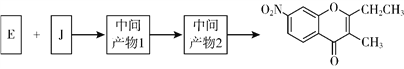
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法不正确的是
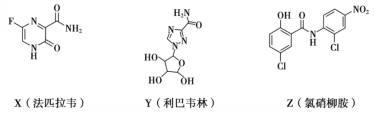
A.X的分子式为C5H4O2N3F
B.Z中含有6种官能团
C.Y和Z都有羟基,但性质不完全相同
D.X和Z都能发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作的叙述错误的是
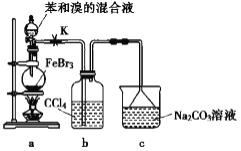
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开 K
B. 实验中装置 b 中的液体逐渐变为浅红色
C. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
D. 装置 c 中的碳酸钠溶液的作用是吸收溴化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚 乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性。以下是我国化学家 近年来合成的聚乙炔衍生物分子 M 的结构式及 M 在稀硫酸作用下的水解过程。
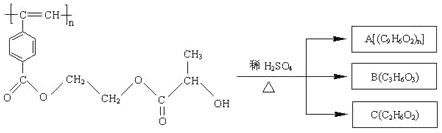
下列有关说法中不正确的是
A. M 与 A 均能使酸性高锰酸钾溶液和溴水褪色
B. B 中含有两种官能团,B 能发生消去反应和缩聚反应
C. A、B、C 各 1 mol 分别不足量金属钠反应,放出的气体的物质的量之比为 1∶2∶2
D. 1 mol M 与热的烧碱溶液反应,可消耗 2n mol 的 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化锰![]() 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入![]() 溶液,充分反应后加入
溶液,充分反应后加入![]() 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入![]() 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
|
|
| |
初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤I中:
①Fe2+浓度降,滤渣中存在![]() 。结合离子方程式解释原因:_______。
。结合离子方程式解释原因:_______。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______。
(3)步骤II中:
①![]() 酸性溶液的作用:_______。
酸性溶液的作用:_______。
②结合离子方程式说明MnCO3的作用: _______。
(4)步骤III通入H2S后, Ni2+不达标而![]() 达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
(5)测定无水![]() 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量![]() ,使
,使![]() 氧化为
氧化为![]() 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵![]() 滴定
滴定![]() ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①样品中MnCl2的质量分数是_____(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的![]() 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是( )
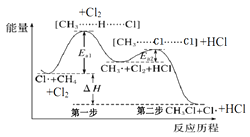
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com