
| A、煤高温干馏 | B、石油减压分馏 |
| C、石油裂化 | D、石油裂解 |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用碱式滴定管量取0.10 mol?L-1的Na2CO3溶液22.10 mL |
| B、配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量 |
| C、用广范pH试纸测某HCl溶液pH=3.6 |
| D、用玻璃棒蘸取HCl溶液滴到湿润的pH试纸上,测其pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
B、 制取少量乙烯气体 |
C、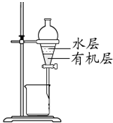 分离CCl4萃取溴水后已分层的有机层和水层 |
D、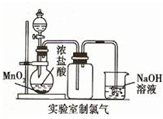 装置制取少量Cl2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行分液操作时,应将分液漏斗颈上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,打开旋塞,使下层液体慢慢沿烧杯壁流下,待下层液体完全流出后,关闭旋塞,上层液体从漏斗上口倒出 |
| B、蒸发操作中,边加热边用玻璃棒搅拌,当加热至蒸发皿中有较多固体析出时,应停止加热,利用余热将液体蒸干 |
| C、过滤操作中,滤纸边缘一定低于漏斗边缘,将玻璃棒靠在三层滤纸的边缘,将烧杯嘴靠在玻璃棒上,慢慢引流倒入液体 |
| D、在配制一定物质的量浓度的溶液的过程中,定容操作就是将蒸馏水注入容量瓶,当液面离容量瓶颈刻度线下2~3cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2的电子式为H:C:::C:H |
| B、酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| C、鸡蛋白溶液中滴加饱和硫酸铵溶液,出现沉淀,该过程属于蛋白质的盐析 |
| D、6个碳原子形成的烃分子中,最多有5个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m1>m2 |
| B、m1≤m2 |
| C、m1≥m2 |
| D、m1=m2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
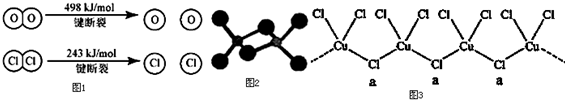
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com