
A、 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
B、 制取少量乙烯气体 |
C、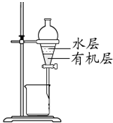 分离CCl4萃取溴水后已分层的有机层和水层 |
D、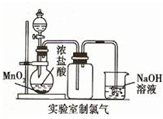 装置制取少量Cl2气体 |


科目:高中化学 来源: 题型:
 氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行:
氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行: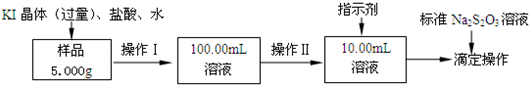
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中阳离子向负极移动 |
| B、用铝质铆钉接铁板,铁易被腐蚀 |
| C、粗铜精炼时,粗铜接直流电源的正极 |
| D、白铁(镀锌)的表面一旦破损,铁腐蚀加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
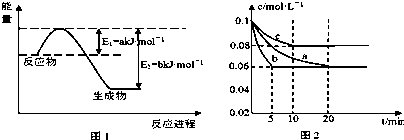
| T/(K) | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
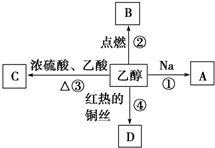 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物.写出下列反应的化学方程式及对应的反应类型:
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物.写出下列反应的化学方程式及对应的反应类型:查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 除杂质的试剂 | 除杂质的方法 |
| 苯(苯酚) | (1) | (4) |
| 酒精(水) | (2) | (5) |
| 乙酸乙酯(乙酸) | (3) | (6) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ksp只与难溶电解质的性质和温度有关 |
| B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C、任意两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
| D、t℃时,Ksp(CaCO3)=4×10-16,则CaCO3饱和溶液中c(Ca2+)=2×10-8 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com