
 氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行:
氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行: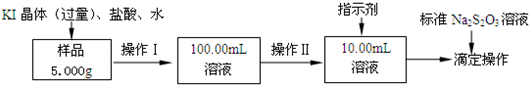
| 0.01817mol×270.5g/mol |
| 5.0g |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
| A、正反应为放热反应 |
| B、正反应为吸热反应 |
| C、A为气体,C为固体 |
| D、A为固体,C为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或结构 |
| T | M层上有2对成对电子 |
| X | 元素最高正价是+7价 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
| A、离子半径从小到大的顺序:Y<Z<T<X |
| B、X、Y形成化合物的晶体类型与X、Z形成化合物的晶体类型不同 |
| C、T的氢化物是同族元素氢化物中沸点最低的 |
| D、X的最高价氧化物对应的水化物是无机含氧酸中的最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
B、 制取少量乙烯气体 |
C、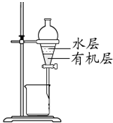 分离CCl4萃取溴水后已分层的有机层和水层 |
D、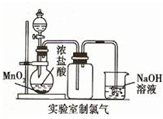 装置制取少量Cl2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com