
ЁОЬтФПЁПввЫсЪЧЩњЮягЭЕФжївЊГЩЗжжЎвЛЃЌввЫсжЦЧтОпгаживЊвтвхЃК
ЗДгІIЃЈШШСбНтЃЉЃКCH3COOH(g)![]() 2CO(g)+2H2(g) ЁїH1
2CO(g)+2H2(g) ЁїH1
ЗДгІIIЃЈЭбєШЛљЃЉЃКCH3COOH(g)![]() CH4(g)+CO2(g) ЁїH2
CH4(g)+CO2(g) ЁїH2
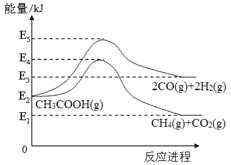
(1)ЁїH1=___________kJ/mol (гУгаЙиEЕФДњЪ§ЪНБэЪО)ЃЛ
(2)ЮЊЬсИпH2ЕФЦНКтВњТЪЃЌгІбЁдёЕФбЙЧПЬѕМўЪЧ_________(ЬюЁАИпбЙЁБЛђЁАГЃбЙЁБ)ЃЛ
(3)дкВЛЭЌЮТЖШЯТЃЌЯђУмБеШнЦїжаГфШыЕШСПДзЫсеєЦћЃЌЗДгІЯрЭЌЪБМфКѓЃЌВтЕУИїЦјЬхЕФВњТЪгыЮТЖШЕФЙиЯЕШчЭМЃК
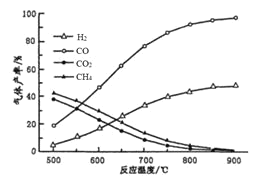
ЂйдМ650ЁцжЎЧАЃЌЧтЦјВњТЪЕЭгкМзЭщЕФдвђЪЧЃЛ________________________________ЃЛ
ЂкдМ650ЁцжЎКѓЃЌЫцзХЮТЖШЩ§ИпКѓЃЌЧтЦјВњТЪИпгкМзЭщЕФдвђЪЧЃК___________ЃЛЃЈЬюБрКХЃЉ
a. ЗДгІIIЫйТЪМѕТ§
b. ЗДгІIЫйТЪМгПьЕФГЬЖШБШЗДгІIIДѓ
c. ЗДгІIе§ЯђвЦЖЏЃЌЖјЗДгІIIФцЯђвЦЖЏ
d. ЗДгІIе§ЯђвЦЖЏЕФГЬЖШДѓгкЗДгІIIе§ЯђвЦЖЏЕФГЬЖШ
ЂлИљОнЭМЯёЗжЮіЃЌИУШнЦїжавЛЖЈЗЂЩњСЫСэЭтЕФИБЗДгІЃЌРэгЩЪЧЃК______________ЁЃ
(4)РћгУКЯЪЪЕФДпЛЏМСЪЙСэЭтЕФИБЗДгІВЛЗЂЩњЁЃЮТЖШЮЊTKЃЌДяЕНЦНКтЪБЃЌзмбЙЧПЮЊPkPaЃЌЗДгІIЯћКФввЫс20%ЃЌЗДгІIIЯћКФввЫс50%ЃЌввЫсЬхЛ§ЗжЪ§ЮЊ__________(МЦЫуНсЙћБЃСєlЮЛаЁЪ§ЃЌЯТЭЌ)ЃЛЗДгІIIЕФЦНКтГЃЪ§KpЮЊ_________(KpЮЊвдЗжбЙБэЪОЕФЦНКтГЃЪ§ЃЌФГЮяжЪЗжбЙ=змбЙЁСИУЮяжЪЕФЬхЛ§ЗжЪ§)ЁЃ
ЁОД№АИЁП+(E3-E2) ГЃбЙ ЗДгІIЕФЛюЛЏФмИпгкЗДгІIIЃЌЪЙЩњГЩ![]() ЕФЫйТЪЕЭгкЩњГЩ
ЕФЫйТЪЕЭгкЩњГЩ![]() ЕФЫйТЪ bc ИљОнЗДгІIПДГіЃЌЩњГЩCOгы
ЕФЫйТЪ bc ИљОнЗДгІIПДГіЃЌЩњГЩCOгы![]() ЕФБШР§ЮЊ1:1ЃЌЕЋЭМЯёжаетСНжжЦјЬхЕФВњТЪЯдШЛЗЧ1:1 14.3% 0.4PkPa
ЕФБШР§ЮЊ1:1ЃЌЕЋЭМЯёжаетСНжжЦјЬхЕФВњТЪЯдШЛЗЧ1:1 14.3% 0.4PkPa
ЁОНтЮіЁП
(1)ИљОн![]() =ЩњГЩЮяЕФФмСП
=ЩњГЩЮяЕФФмСП![]() ЗДгІЮяЕФФмСППЩЕУЃК
ЗДгІЮяЕФФмСППЩЕУЃК![]() =+(E3-E2)kJ/molЃЌЙЪД№АИЮЊЃК+(E3-E2)ЃЛ
=+(E3-E2)kJ/molЃЌЙЪД№АИЮЊЃК+(E3-E2)ЃЛ
(2)ЮЊЬсИпH2ЕФЦНКтВњТЪЃЌвЊДйНјЗДгІIЗЂЩњЃЌзюКУвжжЦЗДгІIIЗЂЩњЃЌвђЮЊЗДгІIЕФЦјЬхЗжзгЪ§діМгГЬЖШДѓгкЗДгІIIЃЌвЊзшжЙИБЗДгІЕФНјааЃЌгІбЁдёНЯЕЭбЙЧПЃЌЙЪД№АИЮЊЃКГЃбЙЃЛ
(3)ЂйЗДгІIЕФЛюЛЏФмИпгкЗДгІIIЃЌЪЙЩњГЩ![]() ЕФЫйТЪЕЭгкЩњГЩ
ЕФЫйТЪЕЭгкЩњГЩ![]() ЕФЫйТЪЃЌЫљвддМ
ЕФЫйТЪЃЌЫљвддМ![]() жЎЧАЃЌЧтЦјВњТЪЕЭгкМзЭщЕФЃЌЙЪД№АИЮЊЃКЗДгІIЕФЛюЛЏФмИпгкЗДгІIIЃЌЪЙЩњГЩ
жЎЧАЃЌЧтЦјВњТЪЕЭгкМзЭщЕФЃЌЙЪД№АИЮЊЃКЗДгІIЕФЛюЛЏФмИпгкЗДгІIIЃЌЪЙЩњГЩ![]() ЕФЫйТЪЕЭгкЩњГЩ
ЕФЫйТЪЕЭгкЩњГЩ![]() ЕФЫйТЪЃЛ
ЕФЫйТЪЃЛ
ЂкдМ![]() жЎКѓЃЌЫцзХЮТЖШЩ§ИпКѓЃЌЗДгІIЫйТЪМгПьЕФГЬЖШБШЗДгІIIДѓЃЌЗДгІIЮЊЮќШШЗДгІЃЌЮТЖШЩ§ИпЃЌЦНКте§ЯђвЦЖЏЃЌЖјЗДгІIIЪЧЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтФцЯђвЦЖЏЃЌЫљвдЧтЦјВњТЪИпгкМзЭщЃЌbcТњзуЬтвтЃЌЙЪД№АИЮЊЃКbcЃЛ
жЎКѓЃЌЫцзХЮТЖШЩ§ИпКѓЃЌЗДгІIЫйТЪМгПьЕФГЬЖШБШЗДгІIIДѓЃЌЗДгІIЮЊЮќШШЗДгІЃЌЮТЖШЩ§ИпЃЌЦНКте§ЯђвЦЖЏЃЌЖјЗДгІIIЪЧЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтФцЯђвЦЖЏЃЌЫљвдЧтЦјВњТЪИпгкМзЭщЃЌbcТњзуЬтвтЃЌЙЪД№АИЮЊЃКbcЃЛ
ЂлИљОнЗДгІIПДГіЃЌЩњГЩCOгы![]() ЕФБШР§ЮЊ1:1ЃЌЕЋЭМЯёжаетСНжжЦјЬхЕФВњТЪЯдШЛЗЧ1:1ЃЌдђЫЕУїЛЙгаЦфЫћИБЗДгІдкНјаа,ЙЪД№АИЮЊЃКИљОнЗДгІIПДГіЃЌЩњГЩCOгы
ЕФБШР§ЮЊ1:1ЃЌЕЋЭМЯёжаетСНжжЦјЬхЕФВњТЪЯдШЛЗЧ1:1ЃЌдђЫЕУїЛЙгаЦфЫћИБЗДгІдкНјаа,ЙЪД№АИЮЊЃКИљОнЗДгІIПДГіЃЌЩњГЩCOгы![]() ЕФБШР§ЮЊ1:1ЃЌЕЋЭМЯёжаетСНжжЦјЬхЕФВњТЪЯдШЛЗЧ1:1ЃЛ
ЕФБШР§ЮЊ1:1ЃЌЕЋЭМЯёжаетСНжжЦјЬхЕФВњТЪЯдШЛЗЧ1:1ЃЛ
(4)ЩшввЫсЕФЦ№ЪМСПЮЊa molЃЌЗДгІIЯћКФввЫс20%aЃЌЗДгІIIЯћКФввЫс50%aЃЌдђЙВЯћКФ70%aЃЌдђввЫсЕФЦНКтСП=a-0.2a-0.5a=0.3aЃЌдђЃК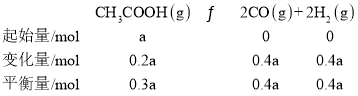 ЃЌ
ЃЌ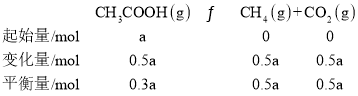 ЃЌдђЦНКтЪБЦјЬхЕФзмЮяжЪЕФСП=0.3a+0.4a+0.4a+0.5a+0.5a=2.1aЃЌввЫсЬхЛ§ЗжЪ§ЮЊЃК
ЃЌдђЦНКтЪБЦјЬхЕФзмЮяжЪЕФСП=0.3a+0.4a+0.4a+0.5a+0.5a=2.1aЃЌввЫсЬхЛ§ЗжЪ§ЮЊЃК![]() ЃЌЗДгІIIЕФЦНКтГЃЪ§
ЃЌЗДгІIIЕФЦНКтГЃЪ§ ЃЌЙЪД№АИЮЊЃК14.3%ЃЛ0.4 PkPaЁЃ
ЃЌЙЪД№АИЮЊЃК14.3%ЃЛ0.4 PkPaЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЛњЮяЗжзгжаЃЌЫљгаЕФдзгВЛПЩФмдкЭЌвЛЦНУцЩЯЕФЪЧЃЈЁЁЁЁЃЉ
A. CH2=CHЁЊCЁдNB. CH2=CHЁЊCH=CH2
C.  D.
D. 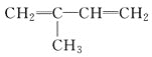
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЁЂBЁЂWЁЂDЁЂEЮЊЖЬжмЦкдЊЫиЃЌЧвдзгађЪ§вРДЮдіДѓЃЌЮхжждЊЫиКЫФкжЪзгЪ§жЎКЭЮЊ39ЃЌBЁЂWЭЌжмЦкЃЌAЁЂDЭЌжїзхЃЌAЁЂWФмаЮГЩСНжжвКЬЌЛЏКЯЮяA2WКЭA2W2ЃЌEдЊЫиЕФжмЦкађЪ§гыжїзхађЪ§ЯрЕШЁЃ
(1)A2WЕФЕчзгЪНЮЊ________ЁЃ
(2)BжажЪзгЪ§КЭжазгЪ§ЯрЕШЕФКЫЫиЗћКХЮЊ____ЃЌEдЊЫидкжмЦкБэжаЕФЮЛжУЮЊ_______ ЁЃ
(3)WЁЂDЁЂEШ§жждЊЫиЕФМђЕЅРызгАыОЖгЩаЁЕНДѓЕФЫГађЮЊ_______(ЬюРызгЗћКХ)ЁЃ
(4)дквЛЖЈЬѕМўЯТЃЌDдЊЫиЕФЕЅжЪФмгыAдЊЫиЕФЕЅжЪЛЏКЯЩњГЩDAЃЌDAФмгыЫЎЗДгІЗХЧтЦјЃЌдђЦфЛЏбЇЗНГЬЪНЮЊ_______ЃЌШєНЋ1molDAКЭ1molEЕЅжЪЛьКЯМгШызуСПЕФЫЎЃЌГфЗжЗДгІКѓЩњГЩЦјЬхЕФЬхЛ§ЪЧ______L(БъзМзДПіЯТ)ЁЃ
(5)ШєвЊБШНЯDКЭEЕФН№ЪєадЧПШѕЃЌЯТСаЪЕбщЗНЗЈПЩааЕФЪЧ_______ЁЃ
a.НЋDЕЅжЪжУгкEЕФбЮШмвКжаЃЌШєЕЅжЪDВЛФмжУЛЛГіЕЅжЪEЃЌЫЕУїDЕФН№ЪєадШѕ
b.НЋЩйСПDЁЂEЕФЕЅжЪЗжБ№ЭЖШыЕНЫЎжаЃЌШєDЗДгІЖјEВЛЗДгІЃЌЫЕУїDЕФН№ЪєадЧП
C.БШНЯЯрЭЌЬѕМўЯТDКЭEЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЕФШмНтадШєЧАепБШКѓепШмНтЖШДѓЃЌЫЕУїDЕФН№ЪєадЧП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўМзУбЃЈDMEЃЉБЛгўЮЊЁА21ЪРМЭЕФЧхНрШМСЯЁБЁЃгЩКЯГЩЦјжЦБИЖўМзУбЕФжївЊдРэШчЯТЃК
Ђй CO(g)+2H2(g)![]() CH3OH(g) ЁїH 1=Ѓ90.7 kJЁЄmol-1
CH3OH(g) ЁїH 1=Ѓ90.7 kJЁЄmol-1
Ђк 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ЁїH 2=Ѓ23.5 kJЁЄmol-1
CH3OCH3(g)+H2O(g) ЁїH 2=Ѓ23.5 kJЁЄmol-1
Ђл CO(g)+H2O(g)![]() CO2(g)+H2(g) ЁїH 3=Ѓ41.2kJЁЄmol-1
CO2(g)+H2(g) ЁїH 3=Ѓ41.2kJЁЄmol-1
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЗДгІ3H2(g)ЃЋ3CO(g)![]() CH3OCH3(g)ЃЋCO2(g) ЁїHЃН____kJЁЄmol-1ЁЃ
CH3OCH3(g)ЃЋCO2(g) ЁїHЃН____kJЁЄmol-1ЁЃ
ЯТСаДыЪЉжаЃЌФмЬсИпCH3OCH3ВњТЪЕФга____ЁЃ
AЃЎЪЙгУКЯЪЪЕФДпЛЏМС BЃЎЩ§ИпЮТЖШ CЃЎдіДѓбЙЧП
ЃЈ2ЃЉНЋКЯГЩЦјвдn(H2)/n(CO)=2ЭЈШы1 LЕФЗДгІЦїжаЃЌвЛЖЈЬѕМўЯТЗЂЩњЗДгІЃК4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) ЁїHЃЌЦфCOЕФЦНКтзЊЛЏТЪЫцЮТЖШЁЂбЙЧПБфЛЏЙиЯЕШчЭМ1ЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ____ЁЃ
CH3OCH3(g)+H2O(g) ЁїHЃЌЦфCOЕФЦНКтзЊЛЏТЪЫцЮТЖШЁЂбЙЧПБфЛЏЙиЯЕШчЭМ1ЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ____ЁЃ
AЃЎЁїH < 0
BЃЎP1<P2<P3
CЃЎШєдкP3КЭ316ЁцЪБЃЌЦ№ЪМn(H2)/n(CO)=3ЃЌдђДяЕНЦНКтЪБЃЌCOзЊЛЏТЪаЁгк50ЃЅ

ЃЈ3ЃЉВЩгУвЛжжаТаЭЕФДпЛЏМСЃЈжївЊГЩЗжЪЧCu-MnЕФКЯН№ЃЉЃЌРћгУCOКЭH2жЦБИЖўМзУбЁЃЙлВьЭМ2ЛиД№ЮЪЬтЁЃДпЛЏМСжаn(Mn)/n(Cu)дМЮЊ____ЪБзюгаРћгкЖўМзУбЕФКЯГЩЁЃ
ЃЈ4ЃЉЭМ3ЮЊТЬЩЋЕчдДЁАЖўМзУбШМСЯЕчГиЁБЕФЙЄзїдРэЪОвтЭМЃЌbЕчМЋЕФЕчМЋЗДгІЪНЮЊ____ЁЃ
ЃЈ5ЃЉМзДМвКЯрЭбЫЎЗЈжЦЖўМзУбЕФдРэЪЧЃК
CH3OH +H2SO4 Ёњ CH3HSO4+H2OЃЌ
CH3 HSO4+CH3OH Ёњ CH3OCH3+H2SO4ЁЃ
гыКЯГЩЦјжЦБИЖўМзУбБШНЯЃЌИУЙЄвеЕФгХЕуЪЧЗДгІЮТЖШЕЭЃЌзЊЛЏТЪИпЃЌЦфШБЕуЪЧ____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПGЪЧвЉЮяКЯГЩжаЕФвЛжжживЊжаМфЬхЃЌЯТУцЪЧGЕФвЛжжКЯГЩТЗЯпЃК

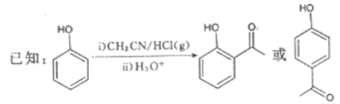
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉBЕФНсЙЙМђЪНЮЊ__________ЃЌЦфжаЫљКЌЙйФмЭХЕФУћГЦЮЊ__________ЃЛBЩњГЩCЕФЗДгІРраЭЮЊ__________ЁЃ
ЃЈ2ЃЉDЕФУћГЦЪЧ__________ЁЃ
ЃЈ3ЃЉгЩCКЭEКЯГЩFЕФЛЏбЇЗНГЬЪНЮЊ________________________________________ЁЃ
ЃЈ4ЃЉDЕФЭЌЗжвьЙЙЬхжаЃЌФмЗЂЩњвјОЕЗДгІЧвЗжзгНсЙЙжаКЌБНЛЗЕФЛЙга__________жжЃЌЦфжаКЫДХЙВеёЧтЦзЩЯга6зщЗхЃЌЗхУцЛ§жЎБШЮЊ1ЁУ1ЁУ1ЁУ1ЁУ1ЁУ1ЕФЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЮЊ______________________ (вЛжжМДПЩ)ЁЃ
ЃЈ5ЃЉВЮееЩЯЪіКЯГЩТЗЯпЃЌвдCH3CH2ClЮЊдСЯ(ЦфЫћЪдМСШЮбЁ)ЃЌЩшМЦжЦБИАЭЖЙШЉ(CH3CH=CH
CHO)ЕФКЯГЩТЗЯпЁЃ_______________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбєМЋФрДІРэКѓЕФГСдќжаКЌAgClЃЌЙЄвЕЩЯПЩгУNa2SO3ШмвКзїНўШЁМСНўГіЛиЪеЁЃФГаЁзщдкЪЕбщЪвФЃФтИУЙ§ГЬЁЃ
вбжЊЃК
iЃЎ25oCЪБЃЌВПЗжЮяжЪЕФШмНтЖШЃКAgCl 1.9ЁС10ЈC4 gЃЛAg2SO3 4.6ЁС10ЈC4 gЃЛAg2SO4ЁЁ0.84 gЁЃ
iiЃЎ25oCЪБЃЌбЧСђЫсФЦШмвКЫсЛЏЙ§жаКЌ![]() ЮЂСЃЕФЮяжЪЕФСПЗжЪ§ЫцpHБфЛЏШчЭМЫљЪОЁЃ
ЮЂСЃЕФЮяжЪЕФСПЗжЪ§ЫцpHБфЛЏШчЭМЫљЪОЁЃ
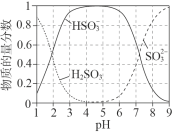
Ђё.НўГіТШЛЏвј
ШЁAgClЙЬЬхЃЌМгШы1 mol/L Na2SO3ШмвКзїНўШЁМСЃЌГфЗжЗДгІКѓЙ§ТЫЕУЕННўГівКЃЈpH=8ЃЉЃЌИУЙ§ГЬжаЗЂЩњЕФЗДгІЮЊAgCl +![]()
![]() [Ag(SO3)2]3ЈC + ClЈCЁЃ
[Ag(SO3)2]3ЈC + ClЈCЁЃ
ЃЈ1ЃЉгУЦНКтвЦЖЏдРэНтЪЭAgClШмНтЕФдвђЪЧ___ЁЃ
Ђђ. ЫсЛЏГСвј
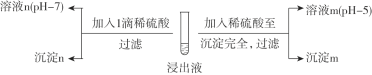
ЃЈ2ЃЉОМьВтЃЌГСЕэmЮЊAgClЃЌдђШмвКmжаКЌ![]() ЮЂСЃЕФжївЊДцдкаЮЪНЪЧ________ЁЃ
ЮЂСЃЕФжївЊДцдкаЮЪНЪЧ________ЁЃ
ЃЈ3ЃЉЬНОПГСЕэnЕФГЩЗжЁЃ
ЂйМзЭЌбЇШЯЮЊГСЕэnвЛЖЈВЛКЌAg2SO4ЃЌЦфвРОнЪЧ________ЁЃ
ЂкввЭЌбЇШЯЮЊГСЕэnПЩФмКЌAg2SO3ЃЌНјааЪЕбщбщжЄЁЃ
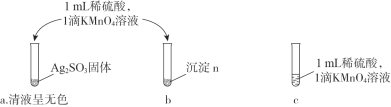
i. БОЪЕбщЩшМЦЕФвРОнЪЧЃКAg2SO3Опга________адЁЃ
ii. ввЭЌбЇЙлВьЕН________ЃЌЕУГіНсТлЁАГСЕэnВЛКЌAg2SO3ЁБЁЃ
ЂлБћЭЌбЇДгШмвКnЕФГЩЗжНЧЖШдйДЮЩшМЦЪЕбщжЄУїГСЕэnВЛКЌAg2SO3ЁЃ

i. БОЪЕбщЩшМЦЕФвРОнЪЧЃКШєГСЕэnКЌAg2SO3ЃЌдђШмвКnжаКЌ![]() ЮЂСЃЕФзмЮяжЪЕФСП___ЃЈЬюЁАЃОЁБЁЂЁАЃНЁБЛђЁАЃМЁБЃЉClЈCЮяжЪЕФСПЁЃ
ЮЂСЃЕФзмЮяжЪЕФСП___ЃЈЬюЁАЃОЁБЁЂЁАЃНЁБЛђЁАЃМЁБЃЉClЈCЮяжЪЕФСПЁЃ
ii. НсКЯЪЕбщЯжЯѓМђЪіБћЭЌбЇЕФЭЦРэЙ§ГЬЃК____ЁЃ
ЂѓЃЎНўШЁМСдйЩњ
ЃЈ4ЃЉШмвКmОДІРэКѓПЩдйгУгкНўГіAgClЃЌЧыМђЪіИУДІРэЗНЗЈ____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЛњЮяЪЕбщЪвжЦБИзАжУе§ШЗЕФЪЧ
|
|
|
|
A. жЦввЯЉ | B. жЦввШВ | C. жЦЯѕЛљБН | D. жЦввЫсввѕЅ |
A. AB. BC. CD. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЮЊдЊЫижмЦкБэЕФвЛВПЗжЃЌЧыВЮеедЊЫи![]() дкБэжаЕФЮЛжУЃЌгУ ЛЏ бЇ гУ гяЛиД№ЯТСаЮЪЬтЃК
дкБэжаЕФЮЛжУЃЌгУ ЛЏ бЇ гУ гяЛиД№ЯТСаЮЪЬтЃК
зх жмЦк | IA | 0 | ||||||
1 |
| ЂђA | ЂѓA | ЂєA | ЂѕA | ЂіA | ЂїA | |
2 |
|
|
| |||||
3 |
|
|
|
| ||||
![]() ЕФдзгНсЙЙЪОвтЭМЮЊ_________ЁЃ
ЕФдзгНсЙЙЪОвтЭМЮЊ_________ЁЃ
![]() ЕФЦјЬЌЧтЛЏЮяЗжзгЕФНсЙЙЪНЮЊ_____________ЁЃ
ЕФЦјЬЌЧтЛЏЮяЗжзгЕФНсЙЙЪНЮЊ_____________ЁЃ
![]() ЁЂ
ЁЂ![]() ЕФзюИпМлКЌбѕЫсЕФЫсадгЩЧПЕНШѕЕФЫГађЪЧ________________ЁЃ
ЕФзюИпМлКЌбѕЫсЕФЫсадгЩЧПЕНШѕЕФЫГађЪЧ________________ЁЃ![]() ЬюЛЏбЇЪН
ЬюЛЏбЇЪН![]()
![]() ЁЂ
ЁЂ![]() дЊЫиЕФН№ЪєадЧПШѕвРДЮЮЊ___________ЁЃ
дЊЫиЕФН№ЪєадЧПШѕвРДЮЮЊ___________ЁЃ![]() ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ
ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ![]()
![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕФаЮГЩЕФМђЕЅРызгАыОЖвРДЮ_______ЁЃ
ЕФаЮГЩЕФМђЕЅРызгАыОЖвРДЮ_______ЁЃ![]() ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ
ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ![]()
![]() ЁЂ
ЁЂ![]() дЊЫиПЩаЮГЩМШКЌРызгМќгжКЌЙВМлМќЕФЛЏКЯЮяЃЌаДГіЫќЕФЕчзгЪНЃК_______ЁЃ
дЊЫиПЩаЮГЩМШКЌРызгМќгжКЌЙВМлМќЕФЛЏКЯЮяЃЌаДГіЫќЕФЕчзгЪНЃК_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
A. гУЖшадЕчМЋЕчНт Na2SO4ШмвКЃЌЕБ 2 mol ЕчзгзЊвЦЪБЃЌПЩМгШы 18 g ЫЎЛжИД
B. гУЖшадЕчМЋЕчНт CuSO4ШмвКЃЌЕБМгШы 1 mol Cu(OH)2ЛжИДЕчНтЧАХЈЖШЪБЃЌЕчТЗжазЊвЦСЫ 4 mol eЃ
C. гУЖшадЕчМЋЕчНт 1 mol CuSO4КЭ 1 mol NaCl ЕФЛьКЯШмвКЃЌШмвКЕФ pH ЯШМѕаЁКѓдіДѓ
D. вЊЯыЪЕЯж CuЃЋH2SO4(ЯЁ) ЈT CuSO4ЃЋH2ЁќЕФЗДгІЃЌашдкЕчНтГижаНјааЃЌЧв Cu ЮЊбєМЋ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com