
下图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是( )

| a电极 | b电极 | X电极 | 溶液 |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:填空题
用如图所示装置进行如下实验:
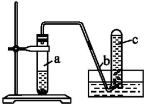
(1)在检查装置的气密性后,向试管a中加入10 mL 6 mol·L-1的稀硝酸和1 g铜片,立即用带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式 。
(2)在实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于 ,
当反应进行一段时间后速率又逐渐减慢,原因是 。
(3)欲较快地制得NO,可采取的措施是 (填写字母序号)。
A.加热B.使用铜粉 C.稀释HNO3D.增大硝酸的浓度
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:选择题
在由水电离出的c(OH-)=1×10-13 mol·L-1的溶液中,能大量共存的离子组是( )
A.Fe2+ Na+ N O3- Cl-
B.Ba2+ Na+ N O3- Cl-
C.S2- S N Na+
D.Mg2+ Na+ Br- ClO-
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3电解原理的应用试卷(解析版) 题型:填空题
硒是制造光电池的一种原料,人体缺少硒就会得“克山病”,从电解精炼铜的阳极泥中提取硒的流程如下:
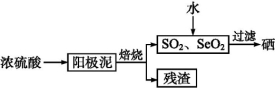
请回答下列问题:
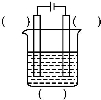
(1)实验室中电解精炼铜的简易装置如图所示,请在图中标出电极材料和电解液的名称。
(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se与浓硫酸反应的化学方程式为 。
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),亚硒酸溶液与SO2反应制硒的离子方程式为 。
电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阳极反应式为 。
(4)上述硒的提取过程中存在的主要问题是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3电解原理的应用试卷(解析版) 题型:选择题
关于镀铜和电解精炼铜,下列说法中正确的是( )
A.都用粗铜作阳极、纯铜作阴极
B.电解液的成分都保持不变
C.阳极反应都只有Cu-2e- Cu2+
Cu2+
D.阴极反应都只有Cu2++2e- Cu
Cu
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3.1电解原理试卷(解析版) 题型:选择题
能用电解原理说明的问题是( )
①电解是把电能转变成化学能
②电解是化学能转变成电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必然导致氧化还原反应的发生
A.①②③④B.②③⑤ C.③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2一次电池二次电池试卷(解析版) 题型:选择题
新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠。已知该电池放电时的电极反应为:正极:FePO4+Li++e- LiFePO4,负极:Li-e-
LiFePO4,负极:Li-e- Li+。下列说法中正确的是( )
Li+。下列说法中正确的是( )
A.充电时动力电池上标注“+”的电极应与外接电源的正极相连
B.放电时电池反应为FePO4+Li++e- LiFePO4
LiFePO4
C.放电时电池内部Li+向负极移动
D.放电时,在正极上Li+得电子被还原
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:填空题
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3·H2O
(2)请你说明丙同学作出该选择的理由是 。
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2水的电离溶液的酸碱性(解析版) 题型:选择题
水的电离过程为H2O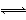 H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低
B.35 ℃时c(H+)>c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小
D.水的电离是个吸热过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com