
| D的单质 |
| D的单质 |
| H2O |
| D的单质 |
| D的单质 |
| H2O |
| D的单质 |
| D的单质 |
| H2O |
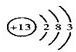 ;B2E为Na2S,硫化钠是离子化合物,硫化钠的电子式为:
;B2E为Na2S,硫化钠是离子化合物,硫化钠的电子式为: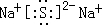 ,
, ;
;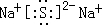 ;
;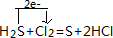 ,
,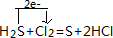 .
.

科目:高中化学 来源: 题型:阅读理解
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.



查看答案和解析>>
科目:高中化学 来源: 题型:








查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com