
| A. | 通过浓硫酸除去SO2中的H2O | B. | 通过灼热的CuO除去H2中的CO | ||
| C. | 通过灼热的镁粉除去N2中的O2 | D. | 通过碱石灰除去O2中的NH3 |
科目:高中化学 来源: 题型:选择题
| A. | 肯定存在NH4+、Cl-、Br- | |
| B. | 是否存在Na+需要通过焰色反应来确定 | |
| C. | SO42-、SO32-至少含有一种 | |
| D. | 肯定不存在Ba2+、Cu2+、SO32-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的氧气与二氧化硫 | B. | 过量的氢氧化钠与二氧化硅 | ||
| C. | 过量的二氧化锰与浓盐酸 | D. | 过量的铜与浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
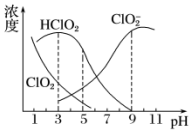 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka约为10-6 | |
| C. | 使用该漂白剂的最佳pH为3 | |
| D. | ClO2可用于自来水的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 推测 |
| A. | Na与冷水反应剧烈,K与冷水反应更剧烈 | Li与冷水反应缓慢 |
| B. | 20Ca(OH)2碱性强于12Mg(OH)2 | 38Sr(OH)2碱性强于20Ca(OH)2 |
| C. | Si是半导体材料,同主族的Ge也是半导体材料 | 第ⅣA元素形成的单质都是半导体材料 |
| D. | F2与H2在暗处剧烈化合,Cl2与H2光照或点燃时反应 | Br2与H2反应需要加热到一定温度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com