
【题目】实验室有一份含有杂质MgCl2和KCl的AlCl3溶液M,某小组用下图所示过程对其进行除杂并尽可能的减少AlCl3的损失。请回答下列问题:

(1)沉淀A的化学式为__________,过程①中Al3+发生反应的离子方程式为__________________。
(2)氢氧化钠溶液_____(填“能”或“不能”)用氨水代替,原因是_____________________。
(3)溶液B中大量存在的阳离子是______________,过程②中生成沉淀C的离子方程式为_____________________________。
【答案】 Mg(OH)2 Al3++4OH- = AlO2-+2H2O 不能 因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开 K+、Na+ AlO2-+2H2O+CO2 = Al(OH)3↓+HCO3-
【解析】向含有杂质MgCl2和KCl的AlCl3溶液M中加入足量的NaOH溶液,Mg2+反应生成Mg(OH)2沉淀,Al3+反应生成AlO2-,则沉淀A为Mg(OH)2,溶液B中含有K+、Na+、AlO2-、OH-、Cl-,向溶液B中通入足量的CO2,AlO2-发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,生成Al(OH)3沉淀,则沉淀C为Al(OH)3,Al(OH)3与盐酸反应生成AlCl3。
(1).根据上述分析可知,沉淀A的化学式为Mg(OH)2,过程①中Al3+与足量的NaOH反应的离子方程式为:Al3++4OH- = AlO2-+2H2O,故答案为:Mg(OH)2;Al3++4OH- = AlO2-+2H2O;
(2).氢氧化钠溶液不能用氨水代替,原因是在Al3+与氨水反应生成Al(OH)3后,氨水是弱碱,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开,故答案为:在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开;
(3)根据上述分析可知,在溶液B中大量存在的阳离子是K+、Na+,过程②中AlO2-与CO2和H2O发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,生成Al(OH)3沉淀,故答案为:K+、Na+;AlO2-+2H2O+CO2 = Al(OH)3↓+HCO3-。


科目:高中化学 来源: 题型:
【题目】下列除杂质的方法可行的是( )
A. 除去CO2中混有的少量CO,通入适量氧气后点燃
B. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
C. 除去乙醇中的少量水,可以加入生石灰再蒸馏
D. 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( ) 
A.A溶液中溶质Na2CO3和NaHCO3物质的量比为l:l
B.A溶液中溶质NaOH和Na2CO3物质的量比为l:l
C.原Na0H 溶液物质的量浓度为0.075mol/L
D.通入CO2气体在标况下的体积为56mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是一种验证某气体化学性质的实验装置,图中 B 为开关。如先打开 B,在A处通入干燥氯气,C 处红色布条颜色无变化;当关闭B,继续通入Cl2 时,C处红色布条颜色褪去。则 D 瓶中盛有的溶液是( )

A. 饱和 NaCl 溶液
B. 浓 H2SO4
C. NaOH 溶液
D. Ca (OH) 2 悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种很重要的金属,可以发生一系列反应制备物质. 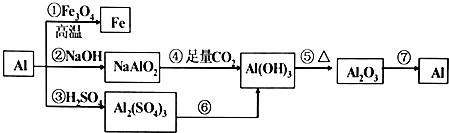
回答下列问题:
(1)反应①可以用于(说出一条).
(2)②③反应产生等量氢气消耗的NaOH与H2SO4的物质的量之比为 .
(3)反应④的离子反应的方程式为 .
(4)用反应⑥制备Al(OH)3 , 最好是向A12(SO4)3溶液中滴加 , 离子方程式为 .
(5)工业上常用反应⑦制备金属铝,制备过程的方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
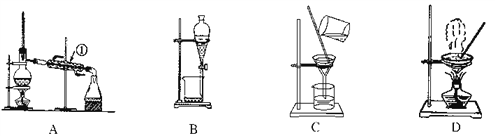
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________。
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.青铜是我国使用最早的合金B.普通钢是纯净物,不锈钢是混合物
C.钢化玻璃是掺入了钢铁的玻璃,因此不易破裂D.光导纤维是以石油为原料生成的合成材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
(1)添加Cu2O的涂料或玻璃显色.
(2)制备氧化亚铜的方法之一是用铜作阳极电解NaCl和NaOH混合溶液,其原理如图所示: 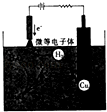
①阴极的电极反应式为 .
②溶液中CuCln1﹣n转化为Cu2O的离子方程式为
(3)工业生产中常采用高温煅烧氧化铜粉末制备Cu2O,但所得产品中会含有一定量CuO,测定产品中Cu2O的含量常用滴定法,其原理为: 样品溶解:Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O.
滴定(未配平):□FeSO4+□KMnO4+□H2SO4═□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
①配平滴定反应的化学方程式.
②滴定时,KMnO4溶液盛放在(填“酸式”或“碱式”)滴定管中.
③若产品质量为1.0g,滴定时消耗0.10molL﹣1的KMnO4标准溶液20.00mL,则产品中Cu2O的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com