
| A. | 假设 | B. | 实验 | C. | 做结论 | D. | 观察 |
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题
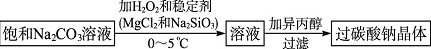
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4,10 | B. | 5,11 | C. | 4,9 | D. | 4,11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | NO2 | 硫酸亚铁 | H2O | 溶液颜色变黄 |
| B | CO2 | 氯化钡溶液 | Ca(OH)2 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | NH3 | AgNO3 | H2SO4 | 先有白色沉淀后溶解 |

| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=+183KJ•mol-1 | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ•mol-1 | |
| D. | 氢气和氯气反应生成1mol氯化氢气体,反应的△H=+183KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如图:
向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
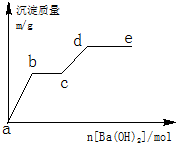 在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.
在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
图示 | 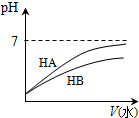 | 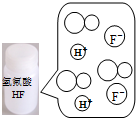 | 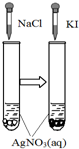 | 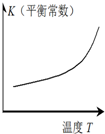 |
| 结论 | HB为弱酸 | HF为弱电解质 | 溶解度:AgI<AgCl | 正反应△H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
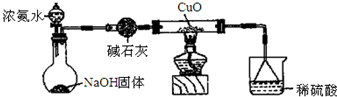
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com