
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=+183KJ•mol-1 | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ•mol-1 | |
| D. | 氢气和氯气反应生成1mol氯化氢气体,反应的△H=+183KJ•mol-1 |
科目:高中化学 来源: 题型:解答题
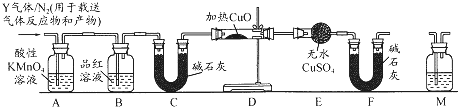
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
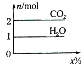 将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )| A | B | C | D | |
| 甲 | 戊烯 | 已烯 | 己二炔(C6H6) | 己烷 |
| 乙 | 环己烷(C6H12) | 苯 | 苯 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
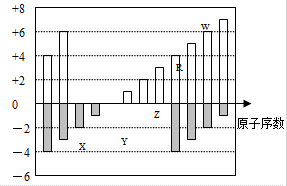
| A. | 单质的氧化性:X>R>W | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一定不能与铜反应 | |
| D. | 离子的氧化性:Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 181kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 假设 | B. | 实验 | C. | 做结论 | D. | 观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 由C(石墨,s)=C(金刚石,s)△H=+1.90 k•Jmol-1可知,金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食用盐中滴加少量淀粉溶液,探究食用盐是否含有IO3- | |
| B. | 新制氯水显酸性,将其滴加到紫色石蕊溶液中,充分振荡后溶液最终为无色 | |
| C. | 氯气具有漂白性,可以将湿润的有色布条漂白为无色物质 | |
| D. | 根据较强酸可以制取较弱酸的规律,结合酸性的强弱顺序H2CO3>HClO>HCO3-,可以推出少量的CO2通入NaClO溶液中能生成HClO和碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com