
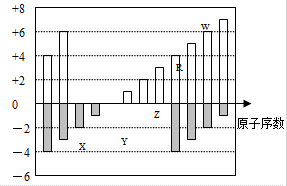
| A. | 单质的氧化性:X>R>W | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一定不能与铜反应 | |
| D. | 离子的氧化性:Z>Y |
分析 几种元素都是短周期元素,有两种元素既有+4价,又有-4价,故前一种元素为碳,后一种元素为硅,故R为Si元素,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、-2价,故W为S元素.结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:为短周期元素,有两种元素既有+4价,又有-4价,故前一种元素为碳,后一种元素为硅,故R为Si元素,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、-2价,故W为S元素,
A、X为O元素,R为Si元素,W为S元素,单质的氧化性:X>W>R,故A错误;
B、非金属性S>Si,故SiH4的稳定性比H2S弱,则气态氢化物的稳定性:R<W,故B正确;
C、SO2和水反应形成的化合物是亚硫酸,亚硫酸与铜不反应,故C正确;
D、Y为Na元素,Z为Al元素,金属单质的还原性:Y>Z,则离子的氧化性:Z>Y,故D正确;
故选A.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,根据推断元素是解题的关键,根据化合价结合原子序数进行推断,首先审题中要抓住“短周期元素”几个字.


科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠 | B. | 碳酸钠,硅酸钠 | C. | 碳酸钠,二氧化硅 | D. | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
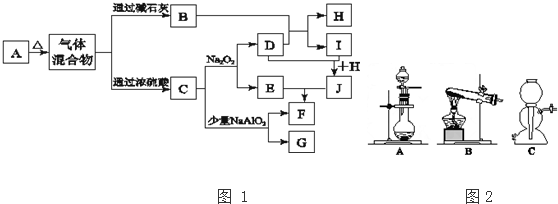
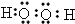 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4,10 | B. | 5,11 | C. | 4,9 | D. | 4,11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
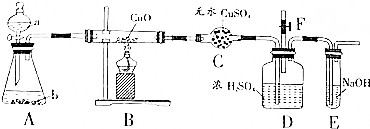
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | NO2 | 硫酸亚铁 | H2O | 溶液颜色变黄 |
| B | CO2 | 氯化钡溶液 | Ca(OH)2 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | NH3 | AgNO3 | H2SO4 | 先有白色沉淀后溶解 |

| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=+183KJ•mol-1 | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ•mol-1 | |
| D. | 氢气和氯气反应生成1mol氯化氢气体,反应的△H=+183KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
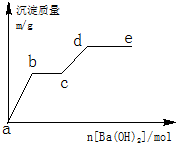 在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.
在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com