
【题目】按要求写出下列反应的方程式(必要时注明反应条件)
(1)实验室制备氯气的化学反应方程式 _______________。
(2)乙醇催化氧化反应(铜作催化剂)_______________。
(3)苯与浓硝酸反应____________________。
(4)CH3CH=CH2发生加聚反应___________________
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2CH3CH2OH+O2
MnCl2+Cl2↑+2H2O 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O ![]() nCH2=CH-CH3
nCH2=CH-CH3![]()
![]()
【解析】
(1)实验室用浓盐酸与MnO2混合加热制备氯气;
(2)乙醇在Cu催化作用下反应产生乙醛和水;
(3)苯与浓硝酸在浓硫酸存在和加热条件下发生取代反应,产生硝基苯和水;
(4)CH3CH=CH2在一定条件下,断裂碳碳双键中较活泼的键,然后这些不饱和的碳原子彼此连接形成高分子化合物;
(1)实验室用浓盐酸与MnO2混合加热制备氯气,反应的方程式是:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)乙醇在Cu催化作用下反应产生乙醛和水,反应方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)苯与浓硝酸在浓硫酸存在和加热条件下发生取代反应,产生硝基苯和水,反应方程式为:![]() ;
;
(4)CH3CH=CH2在一定条件下,断裂碳碳双键中较活泼的键,然后这些不饱和的碳原子彼此连接形成高分子化合物聚丙烯,反应方程式为:nCH2=CH-CH3![]()
![]() 。
。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
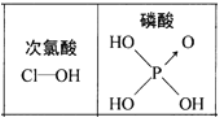
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.乳酸(![]() )存在对映异构体,因为其分子中含有一个手性碳原子
)存在对映异构体,因为其分子中含有一个手性碳原子
C.在NH3分子中存在极性共价键和配位键
D.由上图知酸性: ![]() ,因为
,因为![]() 分子中有非羟基氧原子
分子中有非羟基氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl=SiHCl3+H2
③SiHCl3与过量H2在1 100 ℃反应制得纯硅,已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_____。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为_____。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):

①装置B中的试剂是_____,装置C中的烧瓶需要加热,其目的是______。
②反应一段时间后,装置D中观察到的现象是____,装置D中发生反应的化学方程式为____。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及____。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是____(填写字母代号)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
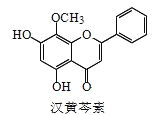
A.汉黄芩素的分子式为 C16H13O5
B.与足量 H2发生加成反应后,该分子中官能团的种类减少 1 种
C.1 mol 该物质与溴水反应,最多消耗 1mol Br2
D.该物质遇 FeCl3 溶液显色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列叙述正确的是:
①标准状况下,11.2升乙醇完全燃烧产生的CO2的 分子数为0.5NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为![]()
③60gSiO2晶体中含有2NA个Si-O键
④某条件下,将1mol N2和3mol H2在密闭容器中充分反应,生成NH3分子数为2NA
⑤常温下7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
A.①④B.②③C.③⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酸是无色液体,密度1.79g·cm-3,沸点约152℃。氯磺酸有强腐蚀性,遇湿空气产生强烈的白雾,故属于危险品。制取氯磺酸的典型反应是在常温下进行的,反应为 HCl(g)+SO3 = HSO3Cl。实验室里制取氯磺酸可用下列仪器装置(图中夹持、固定仪器等已略去),实验所用的试剂、药品有:①密度1.19g·cm-3浓盐酸 ②密度1.84g·cm-3、质量分数为98.3%的浓硫酸 ③发烟硫酸(H2SO4··SO3) ④无水氯化钙 ⑤水。制备时要在常温下使干燥的氯化氢气体和三氧化硫反应,至不再吸收HCl时表示氯磺酸已大量制得,再在干燥HCl气氛中分离出氯磺酸。
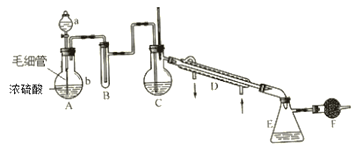
(1)仪器中应盛入的试剂与药品(填数字序号):A中的a____ B____ C_____ F_____ 。
(2)A的分液漏斗下边接有的毛细管是重要部件,在发生气体前要把它灌满a中液体,在发生气体时要不断地均匀放出液体。这是因为______________________________________。
(3)实验过程中需要加热的装置是___________________ (填装置字母)。
(4)若不加F装置,可能发生的现象是________________________________________, 有关反应的化学方程式______________________________________________________。
(5)在F之后还应加的装置是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
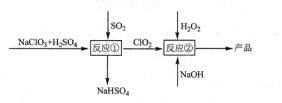
下列说法错误的是( )
A. 反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B. 若反应①通过原电池来实现,则ClO2是正极产物
C. 反应②中的H2O2可用NaClO2代替
D. 反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使石蕊试液显蓝色的溶液:Na+、Al3+、NO![]() 、SO
、SO![]()
B.能使甲基橙显红色的溶液:Mg2+、K+、HCO![]() 、Cl-
、Cl-
C.c(NaCl)=0.1 mol·L-1的溶液:NH![]() 、Ca2+、NO
、Ca2+、NO![]() 、Br-
、Br-
D.KW/c(OH-)=0.1 mol·L-1的溶液:Na+、Fe2+、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
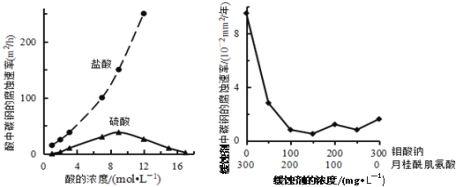
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com