
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
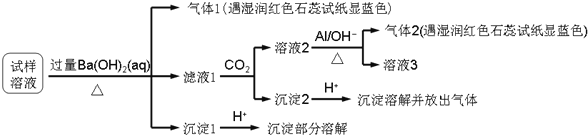
已知:![]() ,根据以上的实验操作和现象,该同学得出的结论不正确的是
,根据以上的实验操作和现象,该同学得出的结论不正确的是![]()
A.试样中肯定存在![]() 、
、![]() 、
、![]() 和
和![]()
B.试样中一定不含![]()
C.试样中可能存在![]() 、
、![]()
D.该雾霾中可能存在![]() 、
、![]() 和
和![]()
【答案】B
【解析】
试样溶液中加入过量![]() 并加热,生成的气体1能使湿润的红色石蕊试纸变蓝色,说明气体1是
并加热,生成的气体1能使湿润的红色石蕊试纸变蓝色,说明气体1是![]() ,则试样中含有
,则试样中含有![]() ;
;
向滤液中通入![]() ,得到溶液2、沉淀2,溶液2中加入Al,生成气体2,该气体能使湿润红色石蕊试纸变蓝色,说明含有气体2是
,得到溶液2、沉淀2,溶液2中加入Al,生成气体2,该气体能使湿润红色石蕊试纸变蓝色,说明含有气体2是![]() ,根据已知条件知,溶液2中含有
,根据已知条件知,溶液2中含有![]() ,根据元素守恒知,原溶液中含有
,根据元素守恒知,原溶液中含有![]() ;
;
滤液1中通入![]() ,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐,也有可能是试样中存在
,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐,也有可能是试样中存在![]() ,在过量的
,在过量的![]() 中反应生成
中反应生成![]() ,通入
,通入![]() 后生成
后生成![]() 沉淀;
沉淀;
沉淀1加入酸后,沉淀部分溶解,硫酸钡不溶于酸,说明原来溶液中含有![]() ,以及能和过量
,以及能和过量![]() 反应生成能溶于酸的沉淀,根据离子知,该沉淀为
反应生成能溶于酸的沉淀,根据离子知,该沉淀为![]() ,所以溶液中含有
,所以溶液中含有![]() ,
,
A.通过以上分析知,试样中肯定存在![]() 、
、![]() 、
、![]() 和
和![]() ,选项A正确;
,选项A正确;
B.通过以上分析知,试样中不能确定是否含有![]() ,选项B错误;
,选项B错误;
C.通过以上分析知,试样中可能存在![]() 、
、![]() ,选项C正确;
,选项C正确;
D.根据以上分析知,试样中肯定存在![]() 、
、![]() 、
、![]() 和
和![]() ,可能存在
,可能存在![]() 、
、![]() ,所以该雾霾中可能存在
,所以该雾霾中可能存在![]() 、
、![]() 和
和![]() ,选项D正确。
,选项D正确。
答案选B。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
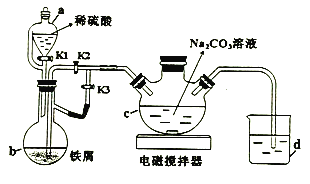
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为_________。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g) + 3N2O(g) = 4N2(g) + 3 H2O(l) △H1
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(l) △H2
△H= _________(用含△H1、△H2的代数式表示)。
(3)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO)(g)CO2(g)十N2(g),“Fe+”常用作该反应的催化剂。 其总反应分两步进行:
第一步为Fe+ +N2OFeO+ +N2;第二步为________(写化学方程式)。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_______ (填“大于”“小于”或“等于”)第一步反应活化能。
(4)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
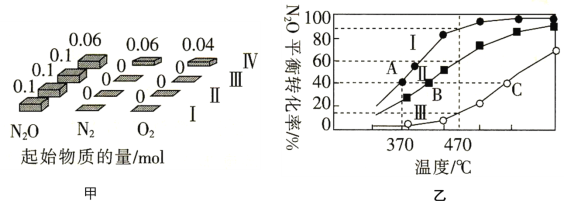
①该反应的△H________(填“>”或“<”)0。
②容器Ⅱ的体积为5L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中O2的反应速率为_________mol.L-1.min-1 ;容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率:![]() 正(N2O)_______
正(N2O)_______![]() 逆(N2O)。(填“>”“<”或“=”)
逆(N2O)。(填“>”“<”或“=”)
③图中A、B、C三点处容器内密度最大的点是_________(填“A”“B”或“C”)。
④已知容器Ⅰ的体积为10L,370℃时,该反应的平衡常数k=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中只可能含有:①Al3+ ②Mg2+③Fe3+④Cu2+⑤H+⑥CO32-⑦NO3-中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是
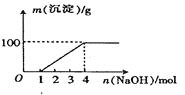
A.②⑤⑦B.②③⑤⑦C.③⑤⑦D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物H是一种光刻胶,其中的一种合成路线如下:

回答下列问题:
(1)B的化学名称是_________。
(2)B生成C的反应类型为_________,F与G反应生成H的反应类型为_________。
(3)H中官能团的名称为___________________________。
(4)C的结构简式为__________________,G的结构简式为__________________。
(5)已知E与D,F与CH3OH分别含有相同的官能团,写出D与CH3OH反应生成E和F的化学方程式:________。
(6)芳香族化合物X是G的同分异构体,1 mol X与足量银氨溶液反应生成4 mol Ag,则X的结构简式有_____(不考虑立体异构)种,写出核磁共振氢谱显示有五种不同化学环境的氢,且峰面积之比为1:2:2:2:1的X的结构简式:___________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHC13)是无色透明液体,不溶于水和浓硫酸,溶于醇,沸点为61.2℃,工业品氯仿中常含有少量乙醇。某校同学设计实验制备少量氯仿。
(1)甲组同学设计下列装置用干燥纯净的氯气制备实验原料漂白粉[已知:3Ca(ClO)2 ![]() Ca(ClO3)2+2CaCl2 △H>0]。
Ca(ClO3)2+2CaCl2 △H>0]。
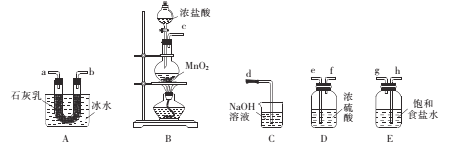
①各仪器接口连接顺序为____(气流白左至右,用小写字母表示)。
②装置B中发生反应的离子方程式为 ___。
③装置A用冰水冷却的目的是____。
(2)乙组同学用甲组制得的漂白粉与乙醇溶液反应制备氯仿的实验装置如图。
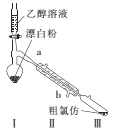
①装置I需控制温度约为70℃,适宜的加热方式是 ___,温度不宜过高,其目的是____。
②装置Ⅱ的名称是____。
③一定条件下,装置I中漂白粉先与乙醇溶液反应生成Cl2和Ca(OH)2,然后Cl2与CH3CH2OH反应生成CCl3CHO,CCl3CHO再与Ca(OH)2反应生成CHC13和一种盐,CCl3CHO与Ca(OH)2反应的化学方程式为 _________。
(3)丙组同学用下列方法对乙组制得的粗产品进行提纯。已知浓硫酸能与乙醇混溶。
步骤I.向粗产品中加入适量浓硫酸,搅拌至呈淡咖啡色,分液得有机层;
步骤Ⅱ.用15%的Na2CO3溶液洗涤多次,分液得有机层;
步骤Ⅲ.向有机层中加入少量无水CaCl2。
步骤I中用浓硫酸洗涤的目的是____;步骤Ⅱ中证明已洗涤干净的依据是____;步骤Ⅲ中加入少量无水CaCl2的目的是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚四氟乙烯的耐热性和化学稳定性超过其他塑料,被称为“塑料王”。其合成路线如下:
三氯甲烷![]() 二氟一氯甲烷
二氟一氯甲烷![]() 四氟乙烯
四氟乙烯![]() 聚四氟乙烯
聚四氟乙烯
下列说法中不正确的是( )
A.“塑料王”不能使酸性高锰酸钾溶液褪色
B.三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应制得
C.四氟乙烯(CF2=CF2)中所有的原子都在同一平面上
D.二氟一氯甲烷(CHClF2)中所有原子最外层电子都达到了8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅氧化还原液流电池作为一种新型铅电池,具有一定的应用前景,正在逐渐成为电化学储能领域的一个研究热点。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是( )
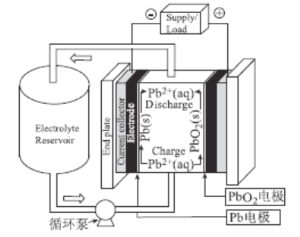
A.放电时,H+经过循环泵向Pb电极移动
B.放电时,正极反应式为PbO2+4H++2e-=Pb2++2H2O
C.充电时,阴极反应式为2H++2e-=H2↑
D.该电解液可用稀H2SO4替代,放电效果相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com