为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是
铁钉表面被钝化
铁钉表面被钝化
;
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y.
①甲同学认为X中除Fe
3+之外还可能含有Fe
2+.若要确认其中的Fe
2+,应选用
d
d
;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO
4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO
2+Br
2+2H
2O═2HBr+H
2SO
4反应,然后加入足量BaCl
2溶液,经适当操作后得干燥固体4.66g.由此推知气体Y中SO
2的体积分数为
80%
80%
.
【探究二】
根据上述实验中SO
2体积分数的分析,丙同学认为气体Y中还可能含有Q
1和Q
2两种气体,其中Q
1气体在标准状况下密度为0.0893g?L
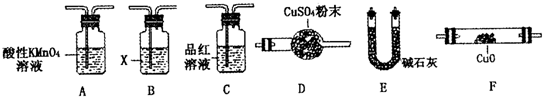
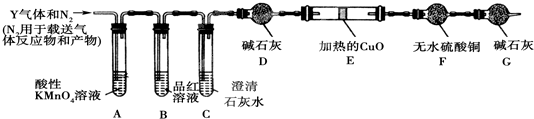
-1.为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应).

(3)装置B中试剂的作用是
检验SO2是否除尽
检验SO2是否除尽
;
(4)分析Y气体中的Q
2气体是如何生成的
(用化学方程式表示);
(5)为确认Q
2的存在,需在装置中添加洗气瓶M于
C
C
;
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q
1,预计实验现象应是
D中固体由黑色变红色和E中固体由白色变蓝色
D中固体由黑色变红色和E中固体由白色变蓝色
.





 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O