
| A、标准状况下,2.24L的水的物质的量为0.1mol |
| B、标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
| C、10.0 g CaCO3和KHCO3的混合物中含有氧原子数为0.3NA |
| D、2.3 g Na与氧气完全反应,反应中转移的电子数介于0.1 NA到0.2NA之间 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、①③⑤ | B、①④⑥ |
| C、③④⑤ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜锌原电池工作时,电子沿外电路从锌电极流向铜电极,再由铜电极经电解质溶液流回到锌电极 |
| B、锂离子电池属于二次电池,是目前手机、笔记本电脑等现代数码产品中应用最广泛的电池 |
| C、乙醇燃料电池可把化学能转化为电能 |
| D、锌锰干电池根据电解质的性质分为酸性碱性两大类,但都是以锌电极为负极,都是锌被氧化的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HS-在水溶液中的电离方程式:HS-+H2O?H3O++S2- | ||
B、H3PO4在水溶液中的电离方程式:H3PO4?3H++P
| ||
| C、NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4- | ||
| D、CaCO3在水溶液中的电离方程式:CaCO3?Ca2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
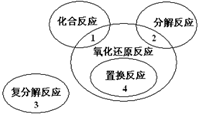 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于1区的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于1区的是( )| A、Cl2+2KBr═Br2+2KCl |
| B、2NaHCO3═Na2CO3+H2O+CO2 |
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| D、2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液滴加碘水:2Fe2++I2═2Fe3++2I- |
| B、双氧水中滴加2滴FeCl3溶液:2Fe3++H2O2═2Fe2++O2↑+2H+ |
| C、双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+O2↑+2H2O |
| D、在Mg(OH)2悬浊液中滴加氯化铵溶液:Mg(OH)2+2NH4Cl═2NH3?H2O+MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5的NH4Cl溶液 |
| B、pH=5的NaHSO4溶液 |
| C、pH=8的CH3COONa溶液 |
| D、pH=8的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com