
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)硫酸铜溶液加快氢气生成的速率,原因是形成原电池;
(3)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等;
(4)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②锌与硫酸反应使锌的表面凹凸不平,有很多细小的锌的颗粒,由于颗粒很小,光被完全吸收,所以看到的固体是灰黑色;Zn能够置换出Cu,出现暗红色;
③生成的单质Cu会沉积在Zn的表面,影响了反应速率;
④溶液的总体积为30mL+20mL=50mL,根据氢气与硫酸的关系计算出△c(H2SO4),再用v=$\frac{△c}{△t}$计算.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,
反应的有关离子方程式为:Zn+2H+═Zn2++H2↑、Zn+Cu2+═Zn2++Cu,
故答案为:Zn+2H+═Zn2++H2↑、Zn+Cu2+═Zn2++Cu;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,
故答案为:升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等;
(4)①要对比试验效果,除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,每组硫酸的量要保持相同,六组反应的总体积也应该相同,A组中硫酸为30mL,那么其它组硫酸量也都为30mL,而硫酸铜溶液和水的总量应相同,F组中硫酸铜20mL,水为0,那么总量为20mL,则V8=20mL-0.5mL=19.5mL,V3=30mL,
故答案为:30;19.5;
②A中没有加入硫酸铜,锌与稀硫酸反应后,锌的表面凹凸不平,有很多细小的锌的颗粒,由于颗粒很小,光被完全吸收,所以看到的固体是灰黑色;Zn能够置换出Cu附着在Zn表面,金属变为暗红,
故答案为:灰黑色;暗红;
③因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积;
④收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,
H2SO4 ~~~~H2,
1mol 22.4L
n(H2SO4) 0.112L
解得:n(H2SO4)=0.005mol,v=$\frac{△c}{△t}$=$\frac{0.005mol}{50×1{0}^{-3}L×10min}$=0.01mol/(L•min),
故答案为:0.01mol/(L•min).
点评 本题考查了影响化学反应速率的因素以及反应速率的计算,本题的易错点在于第(4)小题,V3、V8的求得要注意分析表中数据,题目难度中等.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
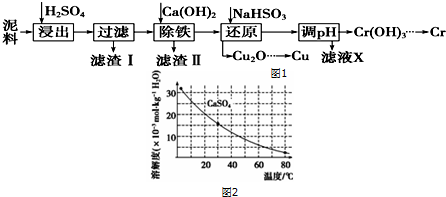
| 物质 | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别NaAlO2溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X 的简单气态氢化物的热稳定性比W 的弱 | |
| B. | 原子半径的大小顺序:rY>rZ>rW>rX | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 最高价氧化物对应水化物的酸性:W比Z 的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
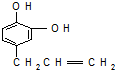

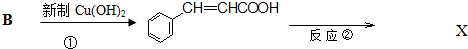
 .反应①的化学方程式为:
.反应①的化学方程式为: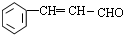 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$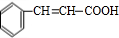 +Cu2O+2H2O.
+Cu2O+2H2O.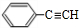 $→_{催化剂}^{HCl}$
$→_{催化剂}^{HCl}$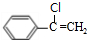 $→_{一定条件}^{CO、H_{2}}$
$→_{一定条件}^{CO、H_{2}}$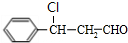 $→_{△}^{NaOH/醇}$
$→_{△}^{NaOH/醇}$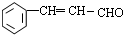 .
.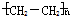
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 苯和乙烯都可使溴的四氯化碳溶液褪色 | |
| D. | 含有醛基和羧基的有机物都能跟银氨溶液发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
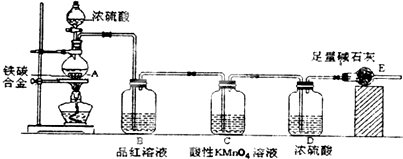
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子内共价键越强,分子越稳定,其熔沸点也越高 | |
| B. | 离子键的本质就是阴、阳离子之间的相互吸引 | |
| C. | 变化过程中化学键被破坏,则一定发生化学变化 | |
| D. | 由原子构成的晶体可能是原子晶体,也可能是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com