
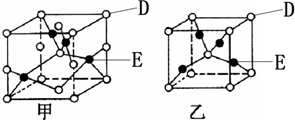
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 8 |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
| A、1 mol苯分子中含有C=C双键数为3NA |
| B、1mol羟基(-OH)所含的电子总数为10NA |
| C、标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA |
| D、5.6g乙烯和丙烯的混合气体中所含碳原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
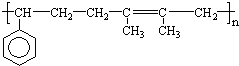
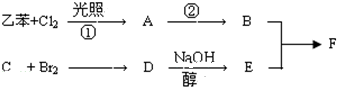
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
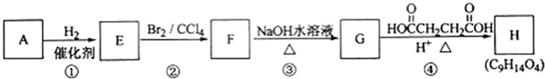
查看答案和解析>>
科目:高中化学 来源: 题型:
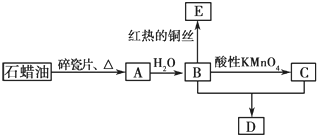
查看答案和解析>>
科目:高中化学 来源: 题型:
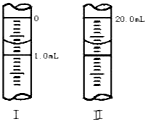 草酸与高锰酸钾在酸性条件下能够发生如下反应:
草酸与高锰酸钾在酸性条件下能够发生如下反应:| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com