
����Ŀ������һ����Ҫ�Ļ���ԭ�ϣ�Ҳ��һ����Ҫ���ܼ�����ش��������⣺

��1����ͼ��ijЩ�л���Ľṹģ�ͣ����б�ʾΪ������_____��
��2����2mL���м���1mL��ˮ�������ã�ʵ������Ϊ_____��
��3����һ�������£����ܷ�������ȡ����Ӧ��д���������������Ļ�ѧ����ʽ____��
��4����һ�������£�����������Ȳ�Ƶã�д����Ȳ��������H2�ڼ��ȼ�ѹ��Ni�������������·�Ӧ��������Ļ�ѧ����ʽ_____��
���𰸡�D ��Һ�ֲ㣬�ϲ�Ϊ�Ⱥ�ɫ����Ȼ�ɫ�����²�Ϊ��ɫ�� ![]() +HNO3
+HNO3 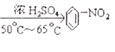 +H2O HC��CH + 2H2
+H2O HC��CH + 2H2![]() CH3CH3
CH3CH3
��������
��1��1����������6��̼ԭ�Ӻ�6����ԭ�ӹ��ɣ����ݸ����ʵĽṹ�ص�����
��2��������ˮ����Ӧ�����ᷢ����ȡ���ݴ˷���ʵ������
��3�����ݱ����ܶ�С��ˮ���������еļ��ǽ��ڵ�����˫��֮���һ�����������ϱ���Ũ������һ�������·���ȡ����Ӧ����������������
��4�������֪��������
��1�������ṹ�ı���ģ���У�AΪ���飬BΪ��ϩ��CΪ���飬DΪ�����ʱ�ʾΪ������D��
��2��2mL���м���1 mL��ˮ����������ˮ�����ܶȱ�ˮС������Һ��ֲ㣬Br2�ᱻ��ȡ���������ԳȺ�ɫ��������Ϊ����Һ�ֲ㣬�ϲ�Ϊ�Ⱥ�ɫ����Ȼ�ɫ�����²�Ϊ��ɫ��
��3��������Ũ���ᣬ��Ũ����������£�ˮԡ���ȵ�50-65��C����ȡ����Ӧ������������ˮ���仯ѧ����ʽΪ��![]() +HNO3
+HNO3 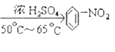 +H2O��
+H2O��
��4����Ȳ�������� H2 �ڼ��ȼ�ѹ��Ni �������������·����ӳɷ�Ӧ�������飬�仯ѧ����ʽΪ��HC��CH + 2H2![]() CH3CH3��
CH3CH3��


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������з�����ӦN2��3H2![]() 2NH3���ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��
2NH3���ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��

�ش��������⣺
(1)����ƽ��״̬��ʱ�����__________(��ѡ��)��
A��t0��t1��������B��t1��t2��������C��t2��t3
D��t3��t4��������E��t4��t5��������F��t5��t6
(2) t1��t3��t4ʱ�̷ֱ�ı��һ��������(��ѡ��)��
A������ѹǿ B����Сѹǿ C�������¶�
D�������¶� E���Ӵ��� F�����뵪��
t1ʱ��__________��t3ʱ��__________��t4ʱ��__________��
(3)����(2)�еĽ��ۣ�����ʱ����У����İٷֺ�����ߵ���______(��ѡ��)��
A��t0��t1����B��t2��t3����C��t3��t4����D��t5��t6
(4)�����t6ʱ�̣��ӷ�Ӧ��ϵ�з�������ְ���t7ʱ�̷�Ӧ�ﵽƽ��״̬������ͼ�л�����Ӧ���ʵı仯���ߡ�_______
(5)һ�������£��ϳɰ���Ӧ�ﵽƽ��ʱ����û�������а������������Ϊ20%����Ӧ���뷴Ӧǰ�Ļ���������֮��Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���е���Ҫ��Ⱦ����NO�Լ�ȼ�ϲ���ȫȼ����������CO��Ϊ�˼��������Ⱦ���������ͨ�����·�Ӧ����������β����2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ��H = a kJ��mol-1��Ϊ�˲ⶨ��ij�ִ��������¸÷�Ӧ�ķ�Ӧ���ʣ�t1���£���һ���ݵ��ܱ������У�ij���л��������崫��������˲�ͬʱ���NO��CO��Ũ�����±���CO2��N2����ʼŨ�Ⱦ�Ϊ0����
2CO2(g)+N2(g) ��H = a kJ��mol-1��Ϊ�˲ⶨ��ij�ִ��������¸÷�Ӧ�ķ�Ӧ���ʣ�t1���£���һ���ݵ��ܱ������У�ij���л��������崫��������˲�ͬʱ���NO��CO��Ũ�����±���CO2��N2����ʼŨ�Ⱦ�Ϊ0����
ʱ�� (s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
�ش��������⣺
��1�������������¸÷�Ӧ���Է����У�������Ӧ��Ȼ��_______��Ӧ��������������������������
��2��ǰ3s�ڵ�ƽ����Ӧ������(N2)=___________��t1��ʱ�÷�Ӧ��ƽ�ⳣ��K=________��
��3���������ܱ������з���������Ӧ���ﵽƽ��ʱ�ı����������������NOת���ʵ���_______��
A��ѡ�ø���Ч�Ĵ��� B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D����С���������
��4����֪��N2(g)+O2(g)=2NO(g) ��H1=��180.5 kJ��mol-1
2C(s)+O2(g)=2CO(g) ��H2����221.0 kJ��mol-1
C(s)+O2(g)=CO2(g) ��H3����393.5 kJ��mol-1
��������β����Ӧ�е�a=__________��
��5���û���̿��ԭ��Ҳ���Դ�����������йط�ӦΪ��C(s)+2NO(g) ![]() CO2(g)+N2(g) ��H4����ij�ܱ���������һ�����Ļ���̿��NO����t2���·�Ӧ���й��������±���
CO2(g)+N2(g) ��H4����ij�ܱ���������һ�����Ļ���̿��NO����t2���·�Ӧ���й��������±���
NO | N2 | CO2 | |
��ʼŨ��/mol��L-1 | 0.10 | 0 | 0 |
ƽ��Ũ��/mol��L-1 | 0.04 | 0.03 | 0.03 |
ƽ��������¶ȣ��ٴδﵽƽ����������NO��N2��CO2��Ũ��֮��Ϊ5:3:3������H4_______0������ >������=������<������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ΪӪ�����������������������ڷ�����Ҫ�ķ�Ӧ�ǣ� ��
A.������ӦB.ȡ����ӦC.�ӳɷ�ӦD.�ۺϷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�����Ϊԭ��������������������к�Fe2O3��SiO2��Al2O3��MgO�ȣ����������Ʊ����죨Fe2O3���Ĺ������£�

�ش��������⣺
��1������ʱ��������������Ŀ����_________________________________________��
��2����ԭ�����м���FeS2��������Һ��Fe2+�ĺ�����ͬʱ��H2SO4���ɣ���ɸ÷�Ӧ�����ӷ���ʽ��_________FeS2+14Fe3++______H2O�T15Fe2++______SO42-+______��
��3������A����Ҫ�ɷ�Ϊ_________��
��4�����������У�Ϊ��ȷ������Ĵ��ȣ�����������Ҫ������Һ��pH�ķ�Χ��___________;(����������������������ʽ����ʱ��Һ��pH���±�)
������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
��ʼ���� | 2.7 | 3.8 | 7.5 | 9.4 |
��ȫ���� | 3.2 | 5.2 | 9.7 | 12.4 |
Ϊ�õ�������Fe(OH)3���壬��Ҫ�Գ�������ϴ�ӣ��жϳ���Fe(OH)3�Ƿ�ϴ���ķ�����____________________��
��5��������Ũ����1��10-5mol/Lʱ����Ϊ�������ȫ����ҪʹMg2+��ȫ������Ҫ����c(OH-)��_____________������֪Ksp[Mg(OH)2]=5.6��10-12��![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��Q��R��ԭ��������������Ķ���������Ԫ�ء���֪������YX3��ʹ��ʪ�ĺ�ɫʯ����ֽ������Z��X��ͬһ���壬Qԭ�ӵ�������������������������2�����ش��������⣺
��1��Q��Ԫ�����ڱ��е�λ��Ϊ___��YX3�ĵ���ʽΪ____����Ԫ�ط��ű�ʾ����
��2��X��Y��Zԭ�ӵİ뾶�Ӵ�С��˳����______����Ԫ�ط��ű�ʾ����
��3��X2Q��Y������������ˮ�����ϡ��Һ��Ӧ������Q���ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ___��
��4����֤��R�ķǽ����Ա�Qǿ��ʵ����ʵ��____������ĸ��ţ���
a��R2��H2���ϱ�Q��H2�������ף���HR���ȶ��Ա�H2Qǿ
b��H2Q��ˮ��Һ��ͨ������R2������û�������Q
c��HR��ˮ��Һ���Ա�H2Q��ˮ��Һ����ǿ
��5������YX3��ˮ�е��ܽ����ر���ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӱ�컯ѧ��Ӧ���ʵ���������У��϶���ʹ��ѧ��Ӧ���ʼӿ�ķ�����
A. �����¶� B. ������� C. ���ӷ�Ӧ�� D. ����ѹǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com