
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生下列反应: 3NF3+5H2O=2NO+HNO3+9HF 。则下列说法正确的是
A.反应过程中,被氧化与被还原的元素的物质的量之比为2:1
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,用石灰水溶液喷淋的方法可以减少污染
D.若反应中转移的电子数目为6.02×1023,生成22.4L NO气体
科目:高中化学 来源:2015-2016学年广东省清远市高二上学期10月月考化学试卷(解析版) 题型:填空题
在一定条件下,xA+yB zC的反应达到平衡。
zC的反应达到平衡。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向 移动。(填“正”、“逆”、“无法判断”)
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是 态。(填“气”、“液”、“固”)
(4)加热后C的质量分数减少,则正反应是 热反应。
查看答案和解析>>
科目:高中化学 来源:2016届河南省英文学校高三上学期期中测试化学试卷(解析版) 题型:填空题
(10分)中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为 。
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾(NO2)的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
写出A与X的溶液反应的离子方程式
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rY> rX >rQ>rW
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.Z元素的氢化物稳定性大于W元素的氢化物稳定性
D.元素Q和Z能形成QZ2型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月阶段测化学试卷(解析版) 题型:简答题
(10分)化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
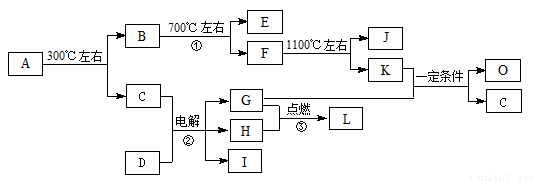
已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:
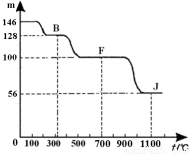
(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
查看答案和解析>>
科目:高中化学 来源:2016届浙江省瑞安市四校高三上学期第一次联考化学试卷(解析版) 题型:推断题
(12分)以下均为中学化学常见物质,存在如下转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
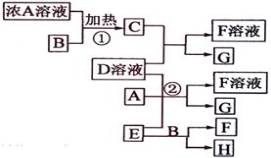
(1)G的化学式 ;F的电子式
(2)反应②的离子方程式 ;
(3)写出另外一种实验室制取H的化学方程式 ;
(4)D溶液中阳离子的焰色反应火焰呈 色;可用 试剂检验D溶液中大量存在的阴离子。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(6分)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净[Cl2Na(NCO)3,氯元素为+1价]先与水反应,生成次氯酸(HClO)起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸)除去。
(1)优氯净中氮元素的化合价为 。
(2)亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 。
(3)亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应:HCO3-+OH-+Ca2+=H2O+Ca CO3↓
B.氯化铵与氢氧化钠溶液混合:NH4++OH-=H2O+NH3↑
C.向漂白粉溶于水形成的溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O= CaSO4↓+Cl-+2HClO
D.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
查看答案和解析>>
科目:高中化学 来源:2016届福建省大田市高三上学期第一次月考化学试卷(解析版) 题型:填空题
现用质量分数为36.5%的浓盐酸(密度为1.19 g/cm3)配制1 mol/L的稀盐酸90 mL。
(1)实验中应选用的仪器是(填序号)____ ____;
①100 mL量筒 ②托盘天平(带砝码) ③玻璃棒 ④50 mL容量瓶
⑤10 mL量筒 ⑥50 mL烧杯 ⑦100 mL容量瓶 ⑧胶头滴管
(2)经计算,需量取浓盐酸的体积为____________mL;
(3)此实验中玻璃棒的作用是_________________________;
(4)某学生实际配制稀盐酸的浓度,经滴定测量为0.98 mol/L,原因可能是下列操作中____ ____。
①取用完浓盐酸的量筒未洗涤
②转移溶液后,小烧杯未洗涤
③定容时俯视容量瓶刻度线
④移液前容量瓶内有少量蒸馏水
⑤定容摇匀后液面下降再加水
⑥定容时仰视容量瓶刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com