
| A�����³�ѹ�µ�б����������ȶ� |
B����б��ת��Ϊ������������仯������ͼ��ʾ |
| C��S(g)+O2(g)��SO2(g)+Q3 Q3>296.83kJ |
| D����Ӧ��������1 L SO2 (g)�ų�297.16kJ���� |
 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��-335.7 kJ��mol��1 | B��-16.3 kJ��mol��1 |
| C��+16.3 kJ��mol��1 | D��-83.7 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 4NO(g)+6H2O(g) ��H =" ��905" kJ/mol ������Ӧ
4NO(g)+6H2O(g) ��H =" ��905" kJ/mol ������Ӧ 2N2(g)+6H2O(g) ��H =" ��1268" kJ/mol �ڸ���Ӧ
2N2(g)+6H2O(g) ��H =" ��1268" kJ/mol �ڸ���Ӧ
 2NO(g)�ķ�Ӧ�Ȧ�H=
2NO(g)�ķ�Ӧ�Ȧ�H= �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 2NH3 (g) ��H<0��
2NH3 (g) ��H<0��| T /K | 298 | 398 |
| ƽ�ⳣ��K | K1 | K2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 2NH3(g)��H<0
2NH3(g)��H<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
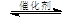 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)| Ͷ�ϱ�[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com