
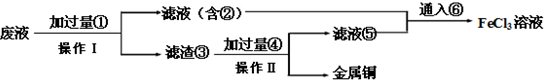


科目:高中化学 来源: 题型:
| A、利用焰色反应可鉴别KC1溶液和NaCl溶液 |
| B、利用丁达尔效应可鉴别溶液和胶体 |
| C、运用过滤的方法,可以分离泥沙和氯化钠溶液混合物 |
| D、用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
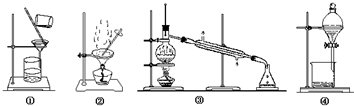
| A、提纯含杂质的工业酒精选择装置③ |
| B、提纯含杂质的粗苯甲酸选择装置①② |
| C、从溴水中提纯溴选择装置④ |
| D、苯中混有少量苯酚选择装置④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的颜色逐渐变浅 |
| B、平衡向正反应方向移动 |
| C、溶液由浅绿色变成黄色 |
| D、平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
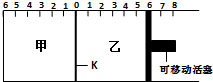 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前的温度.下列有关说法正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前的温度.下列有关说法正确的是( )| A、根据隔板K滑动与否不能判断左右两边的反应是否达到平衡 |
| B、若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
| C、到达平衡时,甲容器中C的物质的量等于乙容器中C的物质的量 |
| D、达到平衡后,隔板K最终停留在左侧刻度0--2之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
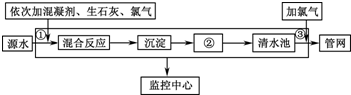 如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R2+>X2+>Z2+>Y2+ |
| B、X2+>R2+>Y2+>Z2+ |
| C、Y2+>Z2+>R2+>X2+ |
| D、Z2+>X2+>R2+>Y2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-57.3mol/L |
| B、-57.3kJ/mol |
| C、+57.3J/mol |
| D、-57.3J/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com