
【题目】设阿伏伽德罗常数的数值为,下列叙述正确的是( )
A.标准状况下,22.4L四氯化碳含有的分子数为NA
B.1 mol硫酸钾中阴离子所带的电荷数为2NA
C.0.5 molL﹣1NaOH溶液中 Na+数为0.5NA
D.常温常压下,16g氧气所含电子数为NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于化学反应的限度的叙述,错误的是
A.化学反应的限度与时间的长短无关
B.化学反应达到限度时,正、逆反应速率相等
C.化学反应的限度是不可改变的
D.任何可逆反应都有一定的限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器或装置,请回答下列问题:
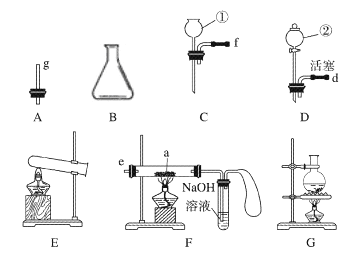
(1)仪器①的名称是_____,②的名称是_____。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是______(填字母);用H2O2与MnO2制O2,并控制产生O2的速率,应选_____(填字母)。
(3)若用装置X进行“排空气法”收集制取的CO2,CO2应从_____(填“b”或“c”)端导入。若瓶中装满水,用排水法收集氧气,氧气应从_____(填“b”或“c”)端导入。
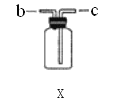
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采用甲酸脱水法(HCOOH![]() CO
CO![]() +H2O),用纯净的CO完成该实验。
+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有_____(填字母),X中应加入的试剂是_____,X与其他导管连接的顺序是_____(填导管口的序号);
②实验时 F装置中气球的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸氢钠溶液与盐酸反应: CO32-+2H+===CO2↑+H2O
B. 氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-![]() H2O+NH3↑
H2O+NH3↑
C. 氢氧化镁与稀硫酸反应:H++OH-===H2O
D. 单质铜与稀硝酸反应:Cu+2H++2NO3-===Cu2++2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了下图实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。

请回答下列问题:
(1)实验前需进行的操作是_______________________________
(2)写出圆底烧瓶中所发生的反应方程式____________________________________________
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是________(用编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为______________
(5)当D中产生______(用字母填写)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉紫色变浅,出气口一端脱脂棉紫色不变
B.脱脂棉上紫色均变浅 C.脱脂棉上紫色褪去
则装置D的作用为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.1mol·L-1HF溶液中加入0.1 mol CaCl2固体(不考虑溶液体积变化),则下列说法中错误的是
A. 原HF溶液c(H+)约为6×10-3mol·L-1
B. 加入 CaCl2后溶液中有CaF2沉淀产生
C. 加入CaCl2后溶液中的c(H+)浓度不变
D. 2HF(aq)+Ca2+(aq)=CaF2(s)+2H+(aq)的平衡常数为K=8.88×102
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴是小组对一种度旧合金(含有Cu、Fe、Si等元素)进行分离、回收利用,所设计工艺流程如下。
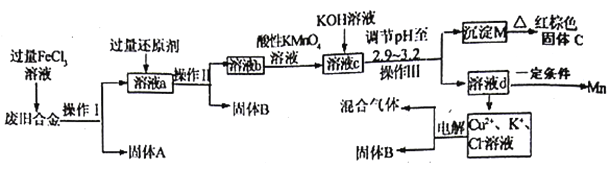
已知298℃时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13,当离子浓度小于1×10-5认为离子沉淀完全。
回答下列问题:
(1)操作I、lI、III为_______,固体A是__________(填化学式)。
(2)加入过量FeC13溶液过程中与较不活泼的金属反应的化学方程式_______。
(3)调节pH至2.9--3.2的目的___________________。
(4)①向溶液b中加入酸性KMn04溶液发生反应的离子方程式为_________________。
②若将溶液b配制成250ml溶液,用滴定管取配制后的溶液25.00m1;再用amol/LKMnO4溶液滴定,恰好反应时消耗KMn04溶液VmL,则流程图中所得红棕色固体C的质量为___g(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后沉淀的金属离子为____________(填金属阳离子)。
(6)用惰性电极电解(Cu2+、K+、C1-溶液)一段时间后,阴、阳两极均产生标准状况下的气体6.72L,阴极析出固体3.2g,则原溶液C1-的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当向蓝色的硫酸铜溶液中逐滴加入氨水,观察到溶液呈深蓝色时,再通入SO2气体,生成了白色沉淀,将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下述描述正确的有( )
A. Cu2+和Ag+相似,能与NH3结合生成铜氨配离子
B. 白色沉淀为+2价铜的某种亚硫酸盐,溶于稀硫酸发生复分解反应
C. 白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,只发生氧化反应
D. 反应过程中消耗的SO2与生成的SO2的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com