
����Ŀ���밴Ҫ��ش������йش�����Ⱦ������������⡣
(1)��������������ʱ�������NO2��������Ҫ��Ӧ�������仯��ͼ��ʾ��

��д��N2��O2��Ӧ���Ȼ�ѧ����ʽ��_______________��
�ڳ�����NH3����NO2ֱ�ӷ�Ӧʵ����ת����д���ô˷�����n(NO)��n(NO2)=1:1ʱ��Ӧ�����棩�Ļ�ѧ����ʽ__________________����֪�÷�Ӧ��H<0��д�����ܼӿ췴Ӧ����������ߵ��������ת���ʵĴ�ʩ֮һ��_________________��
(2)����I2O5����CO��Ⱦ�ķ�ӦΪ��5CO(g)+I2O5(s) ![]() 5CO2(g)+I2(s)����ͬ�¶��£���װ������I2O5�����2L���ݺ����ܱ�������ͨ��2molCO�����CO2�����ʵ�������[��(CO2)]��ʱ��t�仯��������ͼ��ʾ��
5CO2(g)+I2(s)����ͬ�¶��£���װ������I2O5�����2L���ݺ����ܱ�������ͨ��2molCO�����CO2�����ʵ�������[��(CO2)]��ʱ��t�仯��������ͼ��ʾ��

��T1�¶��£�0.5min��CO2��ƽ������Ϊ_______________��
T2�¶��£���ѧƽ�ⳣ��K=_________________��
��a��ʱ�����������ٳ���2molCO���ٴδﵽƽ���(CO2)_______________�����������С�����䡱
(3)����I2����SO2��Ⱦ�Ĺ�ҵ�������£�

�ٷ�Ӧ���з�Ӧ�����ӷ���ʽ��______________________��
���û�ѧƽ���ƶ���ԭ��������ʹ��Ĥ��Ӧ����ʱ�����H2��Ŀ���ǣ�_________��
���𰸡� N2(g)+O2(g)=2NO(g) ��H=-120kJ��mol-1 2NH3+NO+NO2![]() 2N2+3H2O �����������䣬����NH3Ũ�� 0.8mol��L-1��min-1 1024 ���� SO2+I2+2H2O=SO42-+2I-+4H+ HI�ֽ�Ϊ���淴Ӧ����ʱ��������������������ڷ�Ӧ������У������ɸ����I2����ѭ��ʹ��
2N2+3H2O �����������䣬����NH3Ũ�� 0.8mol��L-1��min-1 1024 ���� SO2+I2+2H2O=SO42-+2I-+4H+ HI�ֽ�Ϊ���淴Ӧ����ʱ��������������������ڷ�Ӧ������У������ɸ����I2����ѭ��ʹ��
��������(1)������ͼ��N2��O2��Ӧ���Ȼ�ѧ����ʽΪN2(g)+O2(g)=2NO(g) ��H=1140 kJ��mol-1-1260 kJ��mol-1=-120kJ��mol-1���ʴ�Ϊ��N2(g)+O2(g)=2NO(g) ��H=-120kJ��mol-1��
��������NH3����NO2ֱ�ӷ�Ӧʵ����ת�������ɵ�����ˮ���ô˷�����n(NO)��n(NO2)=1:1ʱ��Ӧ(����)�Ļ�ѧ����ʽΪ2NH3+NO+NO2![]() 2N2+3H2O���÷�Ӧ��H<0�����ܼӿ췴Ӧ����������ߵ��������ת���ʵĴ�ʩ�����������������䣬����NH3Ũ�ȣ��ʴ�Ϊ��2NH3+NO+NO2
2N2+3H2O���÷�Ӧ��H<0�����ܼӿ췴Ӧ����������ߵ��������ת���ʵĴ�ʩ�����������������䣬����NH3Ũ�ȣ��ʴ�Ϊ��2NH3+NO+NO2![]() 2N2+3H2O�������������䣬����NH3Ũ�ȣ�
2N2+3H2O�������������䣬����NH3Ũ�ȣ�
(2)��ͼ���֪T1�¶��£�0��0.5min�ڶ�����̼�������Ϊ0.3����CO�ı仯��Ϊx��
5CO(g)+I2O5(s)5CO2(g)+I2(s)
��ʼ��(mol/L) 1 0
�仯��(mol/L) x x
5min��(mol/L) 1-x x
![]() =0.4����ã�x=0.4���ɷ�Ӧ����v=
=0.4����ã�x=0.4���ɷ�Ӧ����v=![]() =
=![]() =0.8molL-1min-1�� T2�¶��´ﵽƽ�⣬������̼�������Ϊ0.8����һ����̼ת��y
=0.8molL-1min-1�� T2�¶��´ﵽƽ�⣬������̼�������Ϊ0.8����һ����̼ת��y
5CO(g)+I2O5(s)5CO2(g)+I2(s)
��ʼ��(mol/L) 1 0
�仯��(mol/L) y y
ƽ����(mol/L) 1-y y
![]() =0.8����ã�y=0.8mol/L��ƽ�ⳣ��=
=0.8����ã�y=0.8mol/L��ƽ�ⳣ��=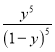 =
= =1024���ʴ�Ϊ��0.8 molL-1min-1��1024��
=1024���ʴ�Ϊ��0.8 molL-1min-1��1024��
��a��ʱ�����������ٳ���2molCO��ƽ�������ƶ������¶Ȳ��䣬ƽ�ⳣ�����䣬����ٴδﵽƽ�����(CO2)���䣬�ʴ�Ϊ�����䣻
(3)��������ͼ��֪���ڷ�Ӧ���У�I2����SO2�����������HI����Ӧ����ʽΪSO2+I2+2H2O=SO42-+2I-+4H+���ʴ�Ϊ��SO2+I2+2H2O=SO42-+2I-+4H+��
��HI�ֽ�Ϊ���淴Ӧ����ʱ���������H2�������ڷ�Ӧ������У������ɸ����I2����ѭ��ʹ�ã��ʴ�Ϊ��HI�ֽ�Ϊ���淴Ӧ����ʱ���������H2�������ڷ�Ӧ������У������ɸ����I2����ѭ��ʹ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ������ȫ����ȷ���ǣ� ��
���� | ǿ����� | ������� | �ǵ���� |
A | NaCl | H2O | Cl2 |
B | H2SO4 | CaCO3 | CCl4 |
C | AgCl | HClO | Cu |
D | Ba(OH)2 | H2S | C2H5OH |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����б仯 ,��Ҫ���뻹ԭ������( )
A.N2��NO
B.HNO3��NO
C.BaCl2��BaSO4
D.Fe2+��Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����·�Ӧ��������ȷ����
I ��C(g)+H2O(g) ![]() CO(g)+H2(g) ��H=+131.0kJ/mol
CO(g)+H2(g) ��H=+131.0kJ/mol
II�� CO(g) +H2O(g) ![]() CO2(g) + H2(g) ��H=-43kJ/mol
CO2(g) + H2(g) ��H=-43kJ/mol
III�� CaO(s) + CO2(g)![]() CaCO3(s) ��H =-178.3 kJ/mol
CaCO3(s) ��H =-178.3 kJ/mol
IV�� C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g) ��H=akJ/mol
CaCO3(s)+2H2(g) ��H=akJ/mol
A. a=+90.3
B. ���º�ѹ�£��ڼ���ƽ��ķ�ӦI��ϵ���ٳ�������Heʱƽ�������ƶ�
C. �����������䣬��ѹ�Է�Ӧ��ķ�Ӧ������Ӱ��
D. �����������䣬�����¶ȿ���߷�Ӧ����CO2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ��Ųⶨ��������������Cԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ��������A��B֮�͵�2����F��ԭ������Ϊ29���ش��������⣺
��1������Ԫ���е�һ������������ ����Ԫ�ط��ţ�������Dԭ�Ӽ۵����Ų�ͼΪ ��
��2����̬Eԭ�Ӻ���δ�ɶԵ�����Ϊ ��
��3��BC2�������幹��Ϊ �����以Ϊ�ȵ�����ķ����� ��д��ѧʽ����
��4��FC�ڼ�������������ת��ΪF2C����ԭ�ӽṹ�ĽǶȽ���ԭ�� ��F����Ķѻ���ʽΪ ������ţ���
���������ѻ� �������������� ���������ܶѻ� �������������ܶѻ�
��5������D���γ�һ����ĥ����G����ṹ����ʯ���ƣ���ͼ��������������廯���D�����廯��������������ķ�Χ�кϳɡ�G�ľ����߳�Ϊa Pm����þ����ܶȵı���ʽΪ g�� cm��3����a��NA��ʽ�ӱ�ʾ�����ػ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����F��һ�ֹ㷺�����㾫�ĵ��������ϳ�·������ͼ��ʾ��

��֪��A�ĺ˴Ź���������4�����շ壬�����֮��Ϊ3:3:2:2��E����˳���칹���Ҽ����봿����Һ��Ӧ����ʹ���CCl4��Һ��ɫ��
(1)A�ķ���ʽΪ________����Ӧ�١��ܵķ�Ӧ���ͷֱ�Ϊ_________��_______________��
(2)E���������ŵ����ƣ�____________��
(3)д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ�ݣ�______________________��
��Ӧ�ޣ�______________________��
(4)H��ͬ���칹���ж��֣����ڷ����廯����ģ�����H����______________�֣�
д������һ�ֵĽṹ��ʽ��_______________________��
(5)M��G��ͬϵ���G����Է���������14������MΪԭ�ϣ�����ԭ����ѡ��
�ϳ��л��N�� ��________________���ڷ�����д�м���Ľṹ��ʽ���ڡ������Ϸ����·�д��Ӧ�����������Լ���
��________________���ڷ�����д�м���Ľṹ��ʽ���ڡ������Ϸ����·�д��Ӧ�����������Լ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����ԭ������������������ֶ���������Ԫ�أ�����������������������Ԫ�����ڱ��У�Z��Y��W�����ڣ���X��Y��W�ֱ�λ�ڲ�ͬ���ڣ���Y��Z��W����Ԫ�ص�ԭ������������֮��Ϊ17������˵���������
A. X��Y��Z�����γ����ӻ���������γɹ��ۻ�����
B. Y��ZԪ�ص�ԭ�Ӱ뾶��С˳��ΪY>Z
C. X��Y��Z֮���γɵĺ����������Ϊ10����ֻ��YX3��X2Z
D. Z��WԪ��������⻯��ķе���ȶ��Ծ�ΪH2Z>H2W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���-ͭ����ȼ�ϵ�������ߡ��ɱ��ͣ����й����ķ�չǰ�����õ��ͨ��һ�ָ��ӵ�ͭ��ʴ���������������������зŵ����Ϊ2Li+Cu2O+H2O�T2Cu+2Li++2OH-������˵������ȷ���ǣ� ��

A���ŵ�ʱ�������ĵ缫��ӦʽΪO2+2H2O+4e-=4OH-
B���ŵ�ʱ��Li+������������Cu���ƶ�
C��ͨ����ʱ��ͭ����ʴ���������Cu2O
D��������Ӧ�����У�������ΪO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����ォ���ǵ�����ˮ�Ƴ�����ˮ����õķ����ǣ�������
A.����
B.��ȡ
C.����
D.�ȹ��˺�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com