
����Ŀ��A��B��C��D��E��FΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ��Ųⶨ��������������Cԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ��������A��B֮�͵�2����F��ԭ������Ϊ29���ش��������⣺
��1������Ԫ���е�һ������������ ����Ԫ�ط��ţ�������Dԭ�Ӽ۵����Ų�ͼΪ ��
��2����̬Eԭ�Ӻ���δ�ɶԵ�����Ϊ ��
��3��BC2�������幹��Ϊ �����以Ϊ�ȵ�����ķ����� ��д��ѧʽ����
��4��FC�ڼ�������������ת��ΪF2C����ԭ�ӽṹ�ĽǶȽ���ԭ�� ��F����Ķѻ���ʽΪ ������ţ���
���������ѻ� �������������� ���������ܶѻ� �������������ܶѻ�
��5������D���γ�һ����ĥ����G����ṹ����ʯ���ƣ���ͼ��������������廯���D�����廯��������������ķ�Χ�кϳɡ�G�ľ����߳�Ϊa Pm����þ����ܶȵı���ʽΪ g�� cm��3����a��NA��ʽ�ӱ�ʾ�����ػ���

���𰸡���1��N��![]() ��
��
��2��4��
��3��V��SO2��O3����
��4��Cu2+������Χ�����Ų�Ϊ3d9����Cu+������Χ�����Ų�Ϊ3d10��Ϊȫ���ȶ�״̬��Cu2O���ȶ�������
��5��![]() ��
��
��������������������������Ϣ�ƶϣ�A��B��C��D��E��FΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ��Ųⶨ��������������AΪ̼Ԫ�أ�Cԭ�ӵ������������Ǵ�����3����CΪ��Ԫ�أ�BΪ��Ԫ�أ�D��Bͬ���壬DΪ��Ԫ�أ�E��ԭ��������A��B֮�͵�2����EΪ��Ԫ�أ�F��ԭ������Ϊ29��FΪͭԪ�ء�
��1������Ԫ���е�һ������������N����ԭ�Ӽ۵����Ų�ͼΪ![]() ��
��
��2����Ϊ26��Ԫ�أ���̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2������δ�ɶԵ�����Ϊ4��
��3��NO2���е�ԭ��Ϊsp2�ӻ�������1�Թ¶Ե��ӣ������幹��ΪV�Σ����以Ϊ�ȵ�����ķ�����SO2��
��4��CuO�ڼ�������������ת��ΪCu2O��ԭ����Cu2+������Χ�����Ų�Ϊ3d9����Cu+������Χ�����Ų�Ϊ3d10��Ϊȫ���ȶ�״̬��Cu2O���ȶ���ͭ����Ķѻ���ʽΪ�����������ܶѻ���ѡ����
��5�����뵪���γ�һ����ĥ����BP�������侧���ṹ�����и����1�������к���4��B��4��P����1mol����������Ϊ4mol��42g/mol��1mol���������ΪNA����a��10-10cm��3����þ����ܶȵı���ʽΪ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2 L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ������������ȷ����

A. ��Ӧ��0��10 s�ڣ���Z��ʾ�ķ�Ӧ����Ϊ0��158 mol��L��1��s��1
B. ��Ӧ��0��10 s�ڣ�X�����ʵ���Ũ�ȼ�����0��79 mol��L��1
C. ��Ӧ���е�10 sʱ��Y��ת����Ϊ79.0%
D. ��Ӧ�Ļ�ѧ����ʽΪX(g)��Y(g)�PZ(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش�����������
��1���ô���ʯ��ϡ���ᷴӦ��CO2������CO2������뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ�����в���CO2��������Ϊ____________�Σ�ѡ�OE������EF����FG����������Ҫԭ��Ϊ____________________����Ҫʹ�÷�Ӧ�ķ�Ӧ���ʼӿ죬���д�ʩ�����е���______��ѡ���������

�ٽ�����ʯ����̼��Ʒ�ĩ �ڼ���K2SO4��Һ
�������¶� �ܼ���NaCl����
��2�������÷�Ӧ��Cu+2Ag+=2Ag+Cu2+�����һ����ѧ��أ��ش��������⣺
���õ��ѡ��ĵ������ҺΪ______���ѧʽ����
�ڸ�������Ϊ___________���ѧʽ���������ĵ缫��ӦʽΪ______________��
����������ת�Ƶ���0.025mol����������������Ϊ____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС����ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�
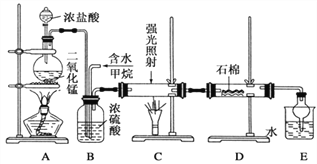
�������Ҫ��ش�
��1��Aװ���з�����Ӧ�����ӷ���ʽ��______________________________��
��2��Bװ�������ֹ��ܣ���___________������ʾ�����ٶȣ��۾��Ȼ�����壻
��3����Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС����������д���û�����ɫС�����Ļ�ѧ����ʽ_________________________��
��4��Dװ�õ�ʯ����KI��Һ����������_______________��
��5��Eװ�ó����������⣬�������л����E�з��������IJ�������Ϊ__________��
��6����װ����ȱ��β������װ�ã�β������Ҫ�ɷ�Ϊ__________��ѡ����ţ���
��CH4��CH3Cl��CH2Cl2��CHCl3 ��CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����л���������ƻ�ṹ��ʽ��
��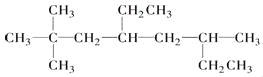 ������Ϊ________________________.
������Ϊ________________________.
��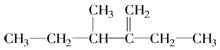 ������Ϊ______________________________.
������Ϊ______________________________.
��2��5-����-2��4-����ϩ�Ľṹ��ʽ��__________________________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ��ش������йش�����Ⱦ������������⡣
(1)��������������ʱ�������NO2��������Ҫ��Ӧ�������仯��ͼ��ʾ��

��д��N2��O2��Ӧ���Ȼ�ѧ����ʽ��_______________��
�ڳ�����NH3����NO2ֱ�ӷ�Ӧʵ����ת����д���ô˷�����n(NO)��n(NO2)=1:1ʱ��Ӧ�����棩�Ļ�ѧ����ʽ__________________����֪�÷�Ӧ��H<0��д�����ܼӿ췴Ӧ����������ߵ��������ת���ʵĴ�ʩ֮һ��_________________��
(2)����I2O5����CO��Ⱦ�ķ�ӦΪ��5CO(g)+I2O5(s) ![]() 5CO2(g)+I2(s)����ͬ�¶��£���װ������I2O5�����2L���ݺ����ܱ�������ͨ��2molCO�����CO2�����ʵ�������[��(CO2)]��ʱ��t�仯��������ͼ��ʾ��
5CO2(g)+I2(s)����ͬ�¶��£���װ������I2O5�����2L���ݺ����ܱ�������ͨ��2molCO�����CO2�����ʵ�������[��(CO2)]��ʱ��t�仯��������ͼ��ʾ��

��T1�¶��£�0.5min��CO2��ƽ������Ϊ_______________��
T2�¶��£���ѧƽ�ⳣ��K=_________________��
��a��ʱ�����������ٳ���2molCO���ٴδﵽƽ���(CO2)_______________�����������С�����䡱
(3)����I2����SO2��Ⱦ�Ĺ�ҵ�������£�

�ٷ�Ӧ���з�Ӧ�����ӷ���ʽ��______________________��
���û�ѧƽ���ƶ���ԭ��������ʹ��Ĥ��Ӧ����ʱ�����H2��Ŀ���ǣ�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں˴Ź��������г�������壬������֮��Ϊ3��2�Ļ�������(����)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��һ�ֽ��壬���ҵ��������ⵥ�ʣ����Գ������Ե���ɫ�������ֽ����ۺ�ϡNa2SO4��Һ��ϣ�װ�ڰ�Ĥ�У�������ʢ����ˮ���ձ��ڣ���һ��ʱ���ȡ�ձ���Һ�����ʵ�飬��֤����Ĥ����������
A������BaCl2��Һ������ɫ���� B�������ˮ������
C������BaCl2 ��Һû�а�ɫ�������� D�������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������һ�����ܱ������м���1mol N2��3mol H2������Ӧ��N2+3H2![]() 2NH3������Ӧ�Ƿ��ȷ�Ӧ���������й�˵����ȷ����
2NH3������Ӧ�Ƿ��ȷ�Ӧ���������й�˵����ȷ����
A. �����¶��ܼӿ췴Ӧ����
B. 1mol N2��3mol H2������������2mol NH3��������
C. �ﵽ��ѧ��Ӧ��ʱ������2molNH3
D. ƽ��ʱ����ֺ���֮��һ������3:1:2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com