
����Ŀ����һ�������Ͻ𣬼��뵽��������������Һ���˳�������ϴ�Ӻ�����һ��������ǡ����ȫ�ܽ⣬��������Һ�м���������ˮ���ڿ����о��������ɫ������������Ϊֹ���������˳������������أ��õ����� �����������ԭ�Ͻ��������ͬ����
��1���Ͻ�������������������Һ������Һ�к��е���������______ ��_______ ��
��2�������˳������������أ��õ���������Ļ�ѧʽΪ____________________��
��3���Ͻ���������������Ϊ__________ ��
���𰸡�![]()
![]()
![]() 30%
30%
��������
�������Ͻ𣬼��뵽��������������Һ������Ӧ����Ƭ����Ӧ������2Al ��2OH����2H2O == 2AlO2����3H2����Ӧ�������Һ����ƫ��������ӣ������������ƹ�������˻�ʣ�����������ӣ��ʴ�ΪAlO2����OH����
���˳������T����ϴ�Ӻ�����һ��������ǡ����ȫ�ܽ⣬�������ᷴӦ�����Ȼ���������������Һ�м���������ˮ������Һ�������������������ڿ����о��������ɫ������������Ϊֹ����������������������Ϊ�����������������˳������������أ������������ȷֽ�Ϊ���������ʴ�ΪFe2O3��
�Ǹ������⣬������������������������������ȣ������������غ㶨�ɵó����������͵�����������������������������������ʵ����������������������������
![]() ���ʴ�Ϊ30%��
���ʴ�Ϊ30%��


 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ�������°����������ܷ�����Ӧ���ɵ�����ˮ������4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H
�������Ͽɵ��йصĻ�ѧ�������������£�
��ѧ�� | N��N | H��O | N��H | O=O |
E/ (kJ��mol��1) | 946 | 463 | 391 | 496 |
�ɴ˼���������Ӧ�ķ�Ӧ����H=___________kJ��mol��1��
��2����֪��N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
ע��K1��K2��K3�ֱ�Ϊ����������Ӧ��ƽ�ⳣ��
�ش��������⣺
�ٰ���������Ӧ(������̬ˮ)��ƽ�ⳣ��KΪ___________(��K1��K2��K3��ʾ)��
��һ�������£���4molNH3��5.2molO2������ݻ�Ϊ4L�ĺ����ܱ������з�����������Ӧ������10s��ﵽƽ�⣬���NO��Ũ��Ϊ0.4mol/L��0��10s�ڣ���NH3��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ___________��O2��ת����Ϊ___________(�ðٷ�����ʾ���ұ���С�����һλ)���÷�Ӧ��ƽ�ⳣ��Ϊ___________(�г�����ʽ����)��
����������Ӧ��һ�δﵽƽ��ʱ�����������������������£�ֻ�ǽ��������������һ�����ٶ���25s��ﵽ�µ�ƽ�⡣������ͼ�������߱�ʾ15~30s�������ϵ��NH3��Ũ����ʱ��仯�����ơ�__________

��3�������йظ÷�Ӧ��˵����ȷ����___________(����ĸ)��
A.���º��ݣ��ٳ���4molNH3��5.2molO2���ٴδﵽƽ��ʱ��NH3��ת��������
B.���º��ݣ��������ڵ��ܶȱ��ֲ���ʱ����Ӧ�ﵽ��ƽ��
C.����������ƽ��Ħ����������ʱ����Ӧ�ﵽ��ƽ��
D.��2v��(NO)=3v��(H2O)ʱ����Ӧ�ﵽ��ƽ��
��4����ҵ�ϳ��ð�ˮ����SO2��������(NH4)2SO3�����жϳ�����(NH4)2SO3��Һ������Բ�ͨ������˵���ж����ݣ�_______________________________________________________��(��֪��NH3��H2O��Kb=1.8��10��5��H2SO3��Ka1=1.3��10��2��Ka2=6.3��10��8)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����þ��й���ǰ����
��1����ͼ�ǴӺ�ˮ����ȡþ�ļ����̣�

��ҵ�ϳ����ڳ���Mg2+���Լ�A��______�����������ƣ���Mg��OH��2ת��ΪMgCl2�����ӷ���ʽ��______��
��2���������и�����I����ʽ���ڵĵ�Ԫ�ء�ʵ������ȡI2��;��������ʾ��
�ɺ���![]() ������
������![]() ��Һ
��Һ![]()
![]()
![]() I2
I2
�����պ������ҽ�ʱ���õ���Ҫ����������______��
�����ữ����Һ�мӹ���������Һ��д���÷�Ӧ�����ӷ���ʽ______��
�۷�Ӧ��������CCl4����ȡ����������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ����������ͼ��
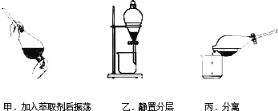
�ס��ҡ���3��ʵ������У�����ȷ����______����ס������ҡ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
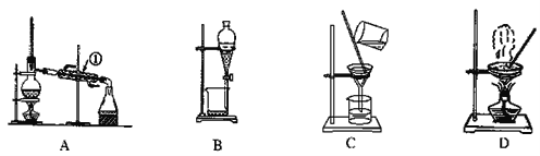
��1�����Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��________�������װ��ͼ����ĸ����ͬ������ȥ����ˮ�е�Cl�������ʣ�ѡ��װ��_______��
��2������ˮ������з����ֲ���ͣ�ѡ��װ��________���÷��뷽��������Ϊ________��
��3��װ��A�Тٵ�������________����ˮ�ķ����Ǵ�_______���������������������ڽ�ˮ��װ��B�ڷ�Һʱ�ϲ�Һ���___________�����������ƣ���___________����������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ȤС��������ͼװ�ý�������ˮ�ķ�Ӧ��ʵ�飬�����ò�����ȡ FeCl36H2O ���塣��ͼ�еIJ� ��װ����ȥ��
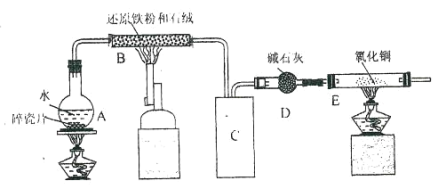
��1��A �е����Ƭ��������_____��B �з�����Ӧ�Ļ�ѧ����ʽΪ__________________��
��2��E װ���е�������_____��
��3��C װ��Ӧ�������е���________��
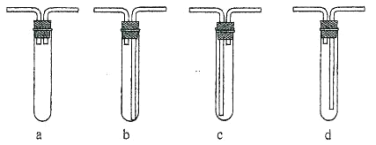
��4����Ӧһ��ʱ�����ȴ��ȡ�� B �еĹ��壬�������ϡ�����ַ�Ӧ����________��
(a)һ������![]() (b)һ������
(b)һ������ ![]()
(c)���ܴ���![]() (d)
(d) ![]() ��
��![]() ֻ����һ�֡�
ֻ����һ�֡�
��5������������![]() �ķ�����_____��
�ķ�����_____��
��6����������Һ���ˣ���Һ![]() ��Һ
��Һ ![]() �Ȼ������塣����(I)ͨ�� Cl2 ��������_____������(II)�ӽ�ϡ����Һ�еõ��������Ҫ��������_____���ڴ˹����б��������Թ�����ԭ����_____��
�Ȼ������塣����(I)ͨ�� Cl2 ��������_____������(II)�ӽ�ϡ����Һ�еõ��������Ҫ��������_____���ڴ˹����б��������Թ�����ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ڹ̶�������ܱ������н��з�Ӧ��N2+3H2![]() 2NH3���÷�Ӧ�ﵽƽ��ı�־��
2NH3���÷�Ӧ�ﵽƽ��ı�־��
A.3v(H2)��=2v(NH3)��B.��λʱ������m mol N2��ͬʱ����3m mol H2
C.���������ܶȲ�����ʱ��仯D.�����ڵ���ѹǿ������ʱ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������У�����X��Y��4mol��һ�������·�����ѧ��Ӧ��2X��g��+ 2Y��g��![]() Z��g��+2 W��g����H<0����Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
Z��g��+2 W��g����H<0����Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
A.5s��ƽ����Ӧ����Ϊ��(Y)=0.2 mol/( L��s)
B.�÷�Ӧ��ƽ�ⳣ����ֵΪ0.5
C.�����ݻ�������䣬��������ͨ������������߷�Ӧ���ת����
D.�����¶ȣ�������������ܶȲ���ʱ����ʾ�÷�Ӧ�Ѿ��ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������������������������к�Al2O3��Fe2O3��FeO��SiO2�ȣ�Ϊԭ���Ʊ����߷����������ۺϼ�ʽ�Ȼ��������������£�
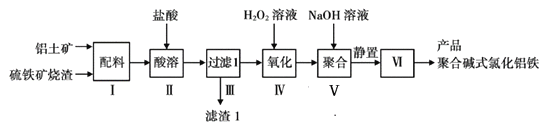
����ʾ��SiO2Ϊ����������Ĺ��壩
��1�������������������������_________________�����������ʱ��Al2O3���ܽ�����ӷ���ʽΪ___________________________________��
��2��������1������Ҫ�ɷ�Ϊ________���ѧʽ����
��3�����������H2O2��Һ��Ŀ����__________��������Ӧ�����ӷ���ʽΪ____________��
��4���������������NaOH��Һ������Ӧ���ɾۺϼ�ʽ�Ȼ���������NaOH������������ɵ�Ӱ����_________������������IJ�����________��ϴ�ӡ����
��5���ⶨ�ۺϼ�ʽ�Ȼ�����[FeaAlb(OH)xCly]n��n(Fe)/n(Al)�ı�ֵ�IJ������£�
����1��ȷ��ȡ��Ʒ5.7100g����ˮ������������ϡ��ˮ�����ˣ��������������������ٱ仯���õ�3.3500g���塣
����2����ȷ��ȡ��ͬ������Ʒ����������NaOH��Һ�����ˣ����ϴ�ӣ��������������������ٱ仯���õ�����0.8000g��
�����Ʒ��![]() �ı�ֵΪ____________��
�ı�ֵΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�����������ȷ����(����)
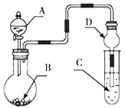
A.��AΪŨ���ᣬBΪNa2CO3��C��ʢ��Na2SiO3��Һ����C����Һ���ְ�ɫ������֤�����ԣ�H2CO3> H2SiO3
B.��AΪŨ���ᣬBΪKMnO4��C��ʢʯ����Һ����C����Һ���ճʺ�ɫ
C.��AΪ��Ũ���ᣬBΪNa2SO3���壬C��ʢ��Na2S��Һ����C����Һ�����
D.װ��D�������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com