
����Ŀ����2L�ܱ������У�����X��Y��4mol��һ�������·�����ѧ��Ӧ��2X��g��+ 2Y��g��![]() Z��g��+2 W��g����H<0����Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
Z��g��+2 W��g����H<0����Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
A.5s��ƽ����Ӧ����Ϊ��(Y)=0.2 mol/( L��s)
B.�÷�Ӧ��ƽ�ⳣ����ֵΪ0.5
C.�����ݻ�������䣬��������ͨ������������߷�Ӧ���ת����
D.�����¶ȣ�������������ܶȲ���ʱ����ʾ�÷�Ӧ�Ѿ��ﵽƽ��״̬
���𰸡�B
��������
A����Ӧ���е�5sʱ���X��ת����Ϊ25%��������X�����ʵ�����4mol��25%��1mol�����ݷ���ʽ��֪ͬʱ����Y�����ʵ�����1mol��Ũ����1mol��2L��0.5mol/L����5 s��ƽ����Ӧ����Ϊ��(Y)= ![]() ��0.1 mol/( L��s)��ѡ��A����
��0.1 mol/( L��s)��ѡ��A����
B��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5 mol/L������ݷ���ʽ��֪W��Ũ�ȣ�1mol/L������X��Y��Ũ�Ⱦ���1mol/L��ʣ��X��Y��Ũ�Ⱦ���2mol/L-1mol/L��1mol/L�����Ը÷�Ӧ��ƽ�ⳣ��![]() ��ѡ��B��ȷ��
��ѡ��B��ȷ��
C�������ݻ�������䣬��������ͨ��������壬���ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�����˲�����߷�Ӧ���ת���ʣ�ѡ��C����
D���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ����ܶ�ʼ�ղ��䣬��������¶ȣ�������������ܶȲ���ʱ������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬��ѡ��D����
��ѡB��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH��Na2CO3�����Һ�еμ�0.1mol��L��1ϡ���ᣬCO2���������������������(V)�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��

A.��0��a��Χ�ڣ�ֻ�����кͷ�Ӧ
B.a��0.3
C.ab�η�����Ӧ�����ӷ���ʽΪCO32-��2H��=CO2����H2O
D.ԭ�����Һ��NaOH��Na2CO3�����ʵ���֮��Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ԭ����Ŀ��11.7g Na2O2����ԭ������ȵ��ǣ� ��
A.5.6g COB.4.4g CO2C.8g SO3D.9.8g H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������Ͻ𣬼��뵽��������������Һ���˳�������ϴ�Ӻ�����һ��������ǡ����ȫ�ܽ⣬��������Һ�м���������ˮ���ڿ����о��������ɫ������������Ϊֹ���������˳������������أ��õ����� �����������ԭ�Ͻ��������ͬ����
��1���Ͻ�������������������Һ������Һ�к��е���������______ ��_______ ��
��2�������˳������������أ��õ���������Ļ�ѧʽΪ____________________��
��3���Ͻ���������������Ϊ__________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��״���£���һ������ˮ���հ������Ƶ�Ũ��Ϊ12.0mol/L���ܶ�Ϊ0.915g/cm3�İ�ˮ���Լ���1���ˮ����________����İ������Ƶ�������ˮ��(ˮ���ܶ���1.00g/cm3��)
(2)����������¿�������������������4FeS2+11O2![]() 8SO2+2Fe2O3�������N2��O2�ĺ����ֱ�Ϊ0.800��0.200(�������)����������и��⣺
8SO2+2Fe2O3�������N2��O2�ĺ����ֱ�Ϊ0.800��0.200(�������)����������и��⣺
��1.00molFeS2��ȫ��������Ҫ���������(��״��)Ϊ_______L��
��55L����������FeS2��ȫ��Ӧ���������(ͬ��ͬѹ)��Ϊ_______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����a��ʾ���ȷ�Ӧ X(g) + Y(g)![]() Z(g) + M(g) + N(s) ��H ��0���й�����X��ת������ʱ��仯�Ĺ�ϵ����Ҫ�ı���ʼ������ʹ��Ӧ���̰�b���߽��У��ɲ�ȡ�Ĵ�ʩ��( )
Z(g) + M(g) + N(s) ��H ��0���й�����X��ת������ʱ��仯�Ĺ�ϵ����Ҫ�ı���ʼ������ʹ��Ӧ���̰�b���߽��У��ɲ�ȡ�Ĵ�ʩ��( )
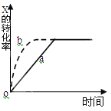
A.�����¶�B.�Ӵ�X��Ͷ����C.�Ӵ���D.�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ����ܱ������У�������Ӧ��![]() �������������й������ٱ仯ʱ�����ܱ����÷�Ӧ�Ѵ�ƽ��״̬����
�������������й������ٱ仯ʱ�����ܱ����÷�Ӧ�Ѵ�ƽ��״̬����![]()
![]()
A.��������ѹǿB.���������ܶ�
C.��������ƽ����Է�������D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LiFePO4��ؾ��������ܶȴ���ɫ�������ŵ㣬�ڿ�������Դ����վ���簲ȫ�����������������õ�Ӧ��ǰ����LiFePO4 ��ؽṹ��ͼ��ʾ����ط�ӦΪ��Li1-xFePO4+ LixC6 ![]() C6+ LiFePO4��
C6+ LiFePO4��

����˵���������
A.���ʱ�� Li+ͨ���ۺ����Ĥ���������ƶ�
B.���ʱ�� ������ӦΪLiFePO4 -xe-=Li1-xFePO4+ xLi+
C.�ŵ�ʱ�� ������ӦΪLixC6 -xe-= xLi++ C6
D.�ŵ�ʱ�����������缫ͨ�����·�����Ҳ�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2+����NH3��H2O��OH����Cl�����γ���λ��Ϊ4������
��1����CuSO4��Һ�м������NaOH��Һ������Na2[Cu��OH��4]��
�ٻ���������[Cu��OH��4]2+�е���λ��__��
��Na2[Cu��OH��4]�г�����λ���⣬�����ڵĻ�ѧ��������__������ţ���
A�����Ӽ� B�������� C�����Թ��ۼ� D���Ǽ��Թ��ۼ�
��2������ͭ�����백ˮ��������ⶼ���ܷ�Ӧ�������백ˮ��������Ļ����Һ�������·�Ӧ��Cu+H2O2+4NH3�T[Cu��OH��4]2++2OH������ԭ����_________________��
��3��Cu2+�������Ҷ�����H2N��CH2CH2��NH2���γ������ӣ���ͼ����

��H��O��N����Ԫ�صĵ縺�ԴӴ�С��˳��____��
���Ҷ���������Nԭ�ӳɼ�ʱ��ȡ���ӻ�������__��
���Ҷ����е����Cl��CH2CH2��Cl����Ҫԭ����__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com