
����Ŀ��LiFePO4��ؾ��������ܶȴ���ɫ�������ŵ㣬�ڿ�������Դ����վ���簲ȫ�����������������õ�Ӧ��ǰ����LiFePO4 ��ؽṹ��ͼ��ʾ����ط�ӦΪ��Li1-xFePO4+ LixC6 ![]() C6+ LiFePO4��
C6+ LiFePO4��

����˵���������
A.���ʱ�� Li+ͨ���ۺ����Ĥ���������ƶ�
B.���ʱ�� ������ӦΪLiFePO4 -xe-=Li1-xFePO4+ xLi+
C.�ŵ�ʱ�� ������ӦΪLixC6 -xe-= xLi++ C6
D.�ŵ�ʱ�����������缫ͨ�����·�����Ҳ�缫
���𰸡�A
��������
A. ���ݵ�ط�ӦLi1-xFePO4+ LixC6 ![]() C6+ LiFePO4֪�����ʱ��LiFePO4xe=Li1xFePO4+xLi+���������������ƶ�����Li+ͨ���ۺ����Ĥ���������ƶ�����A����
C6+ LiFePO4֪�����ʱ��LiFePO4xe=Li1xFePO4+xLi+���������������ƶ�����Li+ͨ���ۺ����Ĥ���������ƶ�����A����
B. ���ʱ���Ҳ�ӵ�Դ����������������ʧ���ӵ�������Ӧ����Ӧ�ɱ�ʾΪLiFePO4xe=Li1xFePO4+xLi+����B��ȷ��
C. �ŵ�ʱ�� ����ʧȥ���ӣ�����������Ӧ����ӦΪLixC6 -xe-= xLi++ C6����C��ȷ��
D. �ŵ�ʱ�������ɸ��������������������缫ͨ�����·�����Ҳ�缫����D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����þ��й���ǰ����
��1����ͼ�ǴӺ�ˮ����ȡþ�ļ����̣�

��ҵ�ϳ����ڳ���Mg2+���Լ�A��______�����������ƣ���Mg��OH��2ת��ΪMgCl2�����ӷ���ʽ��______��
��2���������и�����I����ʽ���ڵĵ�Ԫ�ء�ʵ������ȡI2��;��������ʾ��
�ɺ���![]() ������
������![]() ��Һ
��Һ![]()
![]()
![]() I2
I2
�����պ������ҽ�ʱ���õ���Ҫ����������______��
�����ữ����Һ�мӹ���������Һ��д���÷�Ӧ�����ӷ���ʽ______��
�۷�Ӧ��������CCl4����ȡ����������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ����������ͼ��
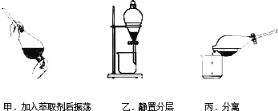
�ס��ҡ���3��ʵ������У�����ȷ����______����ס������ҡ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������У�����X��Y��4mol��һ�������·�����ѧ��Ӧ��2X��g��+ 2Y��g��![]() Z��g��+2 W��g����H<0����Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
Z��g��+2 W��g����H<0����Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
A.5s��ƽ����Ӧ����Ϊ��(Y)=0.2 mol/( L��s)
B.�÷�Ӧ��ƽ�ⳣ����ֵΪ0.5
C.�����ݻ�������䣬��������ͨ������������߷�Ӧ���ת����
D.�����¶ȣ�������������ܶȲ���ʱ����ʾ�÷�Ӧ�Ѿ��ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������������������������к�Al2O3��Fe2O3��FeO��SiO2�ȣ�Ϊԭ���Ʊ����߷����������ۺϼ�ʽ�Ȼ��������������£�
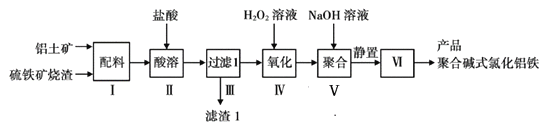
����ʾ��SiO2Ϊ����������Ĺ��壩
��1�������������������������_________________�����������ʱ��Al2O3���ܽ�����ӷ���ʽΪ___________________________________��
��2��������1������Ҫ�ɷ�Ϊ________���ѧʽ����
��3�����������H2O2��Һ��Ŀ����__________��������Ӧ�����ӷ���ʽΪ____________��
��4���������������NaOH��Һ������Ӧ���ɾۺϼ�ʽ�Ȼ���������NaOH������������ɵ�Ӱ����_________������������IJ�����________��ϴ�ӡ����
��5���ⶨ�ۺϼ�ʽ�Ȼ�����[FeaAlb(OH)xCly]n��n(Fe)/n(Al)�ı�ֵ�IJ������£�
����1��ȷ��ȡ��Ʒ5.7100g����ˮ������������ϡ��ˮ�����ˣ��������������������ٱ仯���õ�3.3500g���塣
����2����ȷ��ȡ��ͬ������Ʒ����������NaOH��Һ�����ˣ����ϴ�ӣ��������������������ٱ仯���õ�����0.8000g��
�����Ʒ��![]() �ı�ֵΪ____________��
�ı�ֵΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ��������X������Y����һ�ܱ������У���Ӧ��������Z����Ӧ�����и����ʵ�Ũ�ȱ仯��ͼ(I)��ʾ�����������������䣬��T1��T2�����¶��£�Y����������仯��ͼ(��)��ʾ�����н�����ȷ���ǣ� ��
ͼ(I)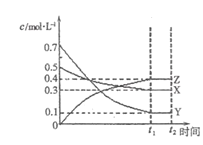 ͼ(��)
ͼ(��)
A.ͼ(��)��T1>T2��������Ӧ�����ȷ�Ӧ
B.t2 minʱ������ѹǿ���䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ�
C.�����������䣬�����¶ȣ������淴Ӧ���ʾ�������X��ת��������
D.T��ʱ�����ܱ������и�������ʼŨ��Ϊ��0.4 mol/L X��0.4 mol/L Y��0.2 mol/L Z�����������������䣬�ﵽƽ��ʱZ��Ũ��Ϊ0.4 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ԭ��Ӧ��������ȷ���ǣ� ��
A.��ѧ��Ӧ�е���ת�Ƶı�ʾ����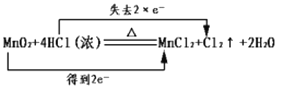
B.����M2O7x����S2-����������Һ�з������·�Ӧ��M2O7x��+3S2��+14H+=2M3+ +3S +7H2O����M2O7x����M�Ļ��ϼ�Ϊ+7
C.�ڳ����·������¼�����Ӧ����16H����10Z����2XO4��=2X2����5Z2��8H2O��2A2����B2=2A3����2B����2B����Z2 =B2��2Z������������Ӧ����֪��������ǿ��˳��Ϊ��XO4����Z2��B2��A3��
D.��֪�������һ���¶��·ֽ�Ϊ5NH4NO3=4N2����2HNO3��9H2O������������Ԫ�غͱ���ԭ��Ԫ�ص�����֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����������õ�������ѧ���ʣ����㷺Ӧ�������������С��Ӻ��ܷ���(��CoO��Co2O3������Al��Li��)����ȡ��CoCl2��6H2O������������ʾ��
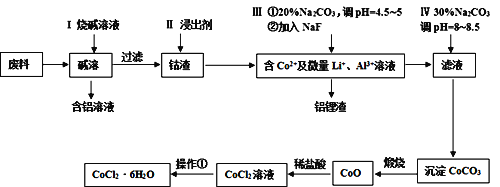
��ش��������⣺
(1)����I����Ҫ�����Ļ�ѧ��Ӧ����ʽΪ______��
(2)��֪Co2O3����ǿ�����ԣ�������II�н�����Ϊ���ᣬ��ɵĺ����_______��
(3)�������Тٵ�Ŀ���dz�ȥAl3+��д���ò���Ӧ�����ӷ���ʽ______��
(4)����ʵ��������CoCO3������Ĺ��������������ƾ��ƺͲ������⣬����______��______(����������)��
(5)����������HCl��Χ�н��еģ��䲽����______��_____�����ˡ�ϴ�ӡ����ϴ�ӹ����п����ù�ҵ�ƾ�����ˮ�����ŵ���_____��
(6)ijͬѧ�ñ���������Һ�ζ�δ֪Ũ�ȵ�CoCl2��Һ�����п���Ϊָʾ������____(��ѡ������������ӵ���ɫ����)
A��KCl B��KSCN C��K2CrO4 D��K2S
��֪����������20��ʱ����ɫ��Kspֵ���±�
��ѧʽ | AgCl | AgSCN | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ |
Ksp | 2.0��10-10 | 1.0��10-12 | 2.0��10-48 | 2.0��10-12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�����������ȷ����(����)
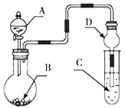
A.��AΪŨ���ᣬBΪNa2CO3��C��ʢ��Na2SiO3��Һ����C����Һ���ְ�ɫ������֤�����ԣ�H2CO3> H2SiO3
B.��AΪŨ���ᣬBΪKMnO4��C��ʢʯ����Һ����C����Һ���ճʺ�ɫ
C.��AΪ��Ũ���ᣬBΪNa2SO3���壬C��ʢ��Na2S��Һ����C����Һ�����
D.װ��D�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���£�N2H4����Ҫ�������������������ȼ�ϡ�
(1) ��֪ �� 2O2(g)��N2(g) === N2O4(l) ��H��a kJ��mol-1
�� N2(g)��2H2(g) === N2H4(l) ��H��b kJ��mol-1
�� 2H2(g) + O2(g) = 2H2O(g) ��H��c kJ��mol-1
ij�ͺŻ������Һ̬�º�Һ̬N2O4���ƽ�����ȼ��������������Ⱦ�����塣д����Ӧ���Ȼ�ѧ����ʽ____��ƫ�����£�1,1-�����£�Ҳ��һ�ָ���ȼ�ϣ�д����ṹ��ʽ______��
��2���¿��Գ�ȥˮ�е��ܽ��������������ܲ������ѭ����д���÷�Ӧ�Ļ�ѧ����ʽ________�������ϣ�ÿ����64 g�¿ɳ�ȥ��״����O2________L
��3����ѧ��������Ϊȼ�ϵ�ص�ȼ�ϣ���ؽṹ��ͼ1��ʾ��

д����ظ����ĵ缫��Ӧʽ��________��
��4��N2H4���ض������£�303K��Pt��Ni�����������Է������ַֽ⣺N2H4(g) ![]() 2H2(g)��N2(g)����2 L���ܱ������м���0.1 mol N2H4(g)�����0-4������N2�����ʵ�����ʱ��ı仯������ͼ2��ʾ��д��0-2������H2��ƽ����Ӧ����v(H2)=________��
2H2(g)��N2(g)����2 L���ܱ������м���0.1 mol N2H4(g)�����0-4������N2�����ʵ�����ʱ��ı仯������ͼ2��ʾ��д��0-2������H2��ƽ����Ӧ����v(H2)=________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com