
【题目】(1)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收________体积的氨气可制得上述氨水。(水的密度以1.00g/cm3计)
(2)硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2![]() 8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
①1.00molFeS2完全氧化,需要空气的体积(标准状况)为_______L。
②55L空气和足量FeS2完全反应后,气体体积(同温同压)变为_______L。
【答案】378 308 52
【解析】
(1)假设溶液体积为1.00L,根据n(NH3)=c(NH3)×V,求出1L溶液中所含氨气的物质的量,求出标准状况下氨气的体积;根据水的质量=氨水的质量-氨气的质量,求出水的质量,进而求出水的体积;由![]() 求出1体积水所吸收氨气的体积;
求出1体积水所吸收氨气的体积;
(2)①根据方程式计算需要氧气的物质的量,再根据V=n·Vm氧气的体积,根据空气中氧气的体积分数计算需要空气的体积;
②计算空气中氧气的体积,利用差量法计算反应后气体体积变化,据此解答。
(1)假设溶液体积为1.00L,1.00L该氨水含氨的物质的量n(NH3)= 1.00L×12.0mol/L=12.0mol,V(NH3)=12.0mol×22.4L/mol=268.8L;1.00L该氨水中含水的质量m(H2O)=1.00L×0.915g/cm3×103mL/L-12.0mol×17.0g/mol=915g-204g=711g;V(H2O)=![]() =0.711L;
=0.711L;![]() =
=![]() =378;
=378;
(2)①根据方程式4FeS2+11O2![]() 8SO2+2Fe2O3可知,1.00molFeS2完全氧化需要氧气物质的量为
8SO2+2Fe2O3可知,1.00molFeS2完全氧化需要氧气物质的量为![]() mol,因此需要空气的体积=(
mol,因此需要空气的体积=(![]() mol×22.4L/mol)÷0.200=308L;
mol×22.4L/mol)÷0.200=308L;
②55L空气中氧气的体积V(O2)=55L×0.200=11.0L,由化学方程式4FeS2+11O2![]() 8SO2+2Fe2O3可知,11mol的O2参加反应变为8molSO2,在同温同压下气体的体积比等于气体的物质的量的比,则11.0L的O2参加反应产生8LSO2,气体体积减少了3L,故反应后气体的体积为55L-3L=52L。
8SO2+2Fe2O3可知,11mol的O2参加反应变为8molSO2,在同温同压下气体的体积比等于气体的物质的量的比,则11.0L的O2参加反应产生8LSO2,气体体积减少了3L,故反应后气体的体积为55L-3L=52L。


科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸。
(1)D元素基态原子的外围电子排布式为____________________。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________(用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
微粒 | CO32- | CO42- |
立体构型名称 | _______________ | _______________ |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是_______。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式___________________。
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为___________,δ、γ、α三种晶胞的边长之比为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组利用下图装置进行铁与水的反应的实验,并利用产物制取 FeCl36H2O 晶体。(图中的部 分装置略去)
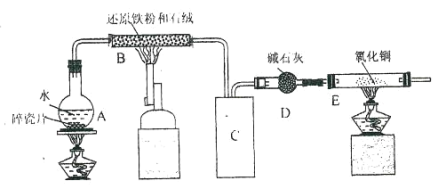
(1)A 中的碎瓷片的作用是_____,B 中发生反应的化学方程式为__________________。
(2)E 装置中的现象是_____。
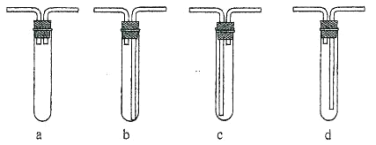
(3)C 装置应该是下列的(________)
(4)反应一段时间后,冷却并取出 B 中的固体,与过量的稀盐酸充分反应后(________)
(a)一定存在![]() (b)一定存在
(b)一定存在 ![]()
(c)可能存在![]() (d)
(d) ![]() 或
或![]() 只存在一种。
只存在一种。
(5)检验其中无![]() 的方法是_____。
的方法是_____。
(6)将上述溶液过滤:滤液![]() 溶液
溶液 ![]() 氯化铁晶体。步骤(I)通入 Cl2 的作用是_____,步骤(II)从较稀的溶液中得到晶体的主要操作包括_____,在此过程中保持盐酸稍过量的原因是_____。
氯化铁晶体。步骤(I)通入 Cl2 的作用是_____,步骤(II)从较稀的溶液中得到晶体的主要操作包括_____,在此过程中保持盐酸稍过量的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:2X(g)+ 2Y(g)![]() Z(g)+2 W(g)△H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2 W(g)△H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
A.5s内平均反应速率为υ(Y)=0.2 mol/( L·s)
B.该反应的平衡常数数值为0.5
C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率
D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(I)所示。保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示。下列结论正确的是( )
图(I)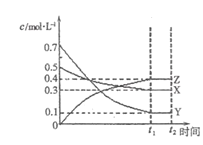 图(Ⅱ)
图(Ⅱ)
A.图(Ⅱ)中T1>T2,则正反应是吸热反应
B.t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大
D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、0.2 mol/L Z,保持其他条件不变,达到平衡时Z的浓度为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内的血红蛋白(Hb)和肌红蛋白(Mb)均可与O2结合,Hb也可以与CO结合。
已知:反应①:Hb(aq)+O2(g)![]() HbO2(aq) H1<0;
HbO2(aq) H1<0;
反应②:Hb(aq)+CO(g)![]() HbCO(aq) H2<0
HbCO(aq) H2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) H3
HbCO(aq)+O2(g) H3
(1)H3=_____(用H1、H2表示);反应③自发进行的趋势较大,则H1_____H2(填“>”、“<”或“=”)
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是_____。
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) ![]() MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是__________。
②该反应平衡总数的表达式为![]() ,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。

③ T℃时,![]() kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com