
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
【答案】浓盐酸 四氧化三铁 2H2O2![]() 2H2O+O2↑ KClO3 催化剂 氧化剂 铁屑 KSCN溶液 溶液呈红色
2H2O+O2↑ KClO3 催化剂 氧化剂 铁屑 KSCN溶液 溶液呈红色
【解析】
本题的突破点是MnO2,在中学化学中MnO2参与的反应主要是氧气和氯气的制备,所以依据框图的转化特点可知B是氧气,D是氯气,C是浓盐酸,E是四氧化三铁,F是氯化亚铁,G是氯化铁;Fe2+具有还原性,因此配制时需要加入铁粉防止被氧化;利用有关元素化合物知识,从质量守恒的角度书写化学方程式。
(1)在中学化学中MnO2参与的反应主要是氧气和氯气的制备,所以依据框图的转化特点可知B是氧气,D是氯气,C是浓盐酸,E是四氧化三铁,F是氯化亚铁,G是氯化铁,故答案为:浓盐酸、四氧化三铁;
(2)MnO2参与制备氧气的反应有两种,一种是由MnO2作催化剂的条件下,加热KClO3分解制得氧气,所以A为KClO3;另一种是MnO2作催化剂的条件下,常温下H2O2分解制得氧气,其反应方程式为2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;KClO3;
2H2O+O2↑;KClO3;
(3)反应①为在二氧化锰作催化剂的条件下产生氧气,反应②为实验室用浓盐酸与二氧化锰加热制备氯气的常用方法,反应中二氧化锰作氧化剂,故答案为:催化剂;氧化剂;
(4)Fe2+具有还原性,易被空气中的氧气所氧化,因此新配制的氯化亚铁溶液需要加入铁粉防止被氧化;检验溶液中是否含有Fe3+,可以向溶液中滴加KSCN溶液,溶液呈红色,即有Fe3+,故答案为:铁屑;KSCN溶液;溶液呈红色。


科目:高中化学 来源: 题型:
【题目】如图所示 3 套实验装置,分别回答下列问题。

(1)装置 1 为铁的吸氧腐蚀实验。向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶 液变红,该电极反应式为_____。
(2)装置 2 中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中 c(Cu2+)_____(填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是 NH4NO3 的琼脂溶液,则盐桥中的_____离子(填“NH4+ ”或“NO3-”)向氯化铁溶液迁移。
(3)装置 3 中甲烧杯盛放 100mL 0.2mol/L 的 NaCl 溶液,乙烧杯盛放 100mL 0.5mol/L 的 CuSO4 溶 液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。
①电源的 M 端为电源_____极。
②乙烧杯中电解反应的离子方程式为_____。
③停止电解,取出 Cu 电极,洗涤、干燥、称量,电极增重 0.32g,甲烧杯中产生的气体标准状况下体积为_________mL。
④若要将乙池设计成电解精炼铜的装置,则乙池的石墨应改成____(填“粗铜”或“精铜”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)最近材料科学家发现了首例带结晶水的晶体在5K下呈现超导性。该晶体的化学式为Na0.35CoO2·1.3H2O(该晶体的摩尔质量为122g·mol-1),若用NA表示阿伏加德罗常数,则12.2g该晶体中含氧原子数为___,氢原子的物质的量为___mol。
(2)FeCl3溶液可以用来净水,用100mL2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数___(填“大于”“等于”或“小于”)0.2NA。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=___mol/L(用以上字母表示,且必须化简)。
(4)工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式____。
(5)向100mL的FeBr2溶液中通入标准状况下Cl23.36L(已知还原性:Fe2+>Br-),反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为____mol/L。反应的离子方程式为____。
(6)若向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向体积为2L的密闭容器中通入NO2 (气体)和N2O4 (无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:

(1)0~3min内用N2O4表示的平均反应速率为___________。
(2)若升高温度,则v(正)__________(填“加快”“减慢”或“不变”,下同),v(逆)___________。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中v(NO2)=0.2mol·L-1·s-1,乙中v(N2O4)=9mol·L-1·min-1,则_________(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是(_____)
A v(NO2)=2 v(N2O4)
B 容器内压强不再发生变化
C X的体积分数不再发生变化
D 容器内气体的原子总数不再发生变化
E 相同时间内消耗n mol Y的同时生成2n mol X
F 相同时间内消耗n mol Y的同时消耗2n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是

A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中氧原子数目与11.7g Na2O2中氧原子数相等的是( )
A.5.6g COB.4.4g CO2C.8g SO3D.9.8g H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.78gNa2O2与足量水充分反应时电子转移数为NA
B.2L1mol/LNa2SO4溶液中离子总数为3NA
C.25℃,101.3kPa时,11.2LH2中含有的原子数为NA
D.4℃,101.3kPa时,54mlH2O中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收________体积的氨气可制得上述氨水。(水的密度以1.00g/cm3计)
(2)硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2![]() 8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
①1.00molFeS2完全氧化,需要空气的体积(标准状况)为_______L。
②55L空气和足量FeS2完全反应后,气体体积(同温同压)变为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸常用于合成镇静剂和麻醉剂等医药用品。已知: 液溴是易挥发的深红棕色液体,沸点为58.78℃。质量分数为47%的氢溴酸是易挥发的无色液体,沸点 为 126℃. 实验室制备质量分数为47%的氢溴酸的一种方法如下。回答下列问题:
实验橾作 | 现象 |
I .向锥形瓶中依次加入适量冰水、m1g 液溴,再通入SO2充分反应 | 得到淡黄色溶液 |
II. 将操作 I 所得溶液转移至蒸馏烧瓶,蒸馏 | 锥形瓶中得橙黄色粗产品 |
III.在不断搅拌下,向锥形瓶中加入适量Na2SO3溶液 | (1)①_____ |
IV.继续加入适量 Ba(OH)2 溶液 | ②______ |
V.过滤,滤液经蒸馏后得质量分数为47%的氢溴酸m2g |
(2)操作 II的蒸馏装置如图所示(部分夹持装置省略),仪器a的名称是_________ ,装置中除缺石棉网外还有两处明显错误,分别是_________、 _______________。
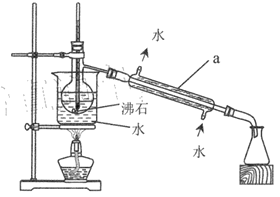
(3)操作III加入适量Na2SO3 发生反应的离子方程式为 __________。
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂 __________检验。若观察到的现象为________,则推测正确。
(5)质量分数为 47%的氢溴酸的产率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com