
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.78gNa2O2与足量水充分反应时电子转移数为NA
B.2L1mol/LNa2SO4溶液中离子总数为3NA
C.25℃,101.3kPa时,11.2LH2中含有的原子数为NA
D.4℃,101.3kPa时,54mlH2O中含有的原子数为3NA
【答案】A
【解析】
A.过氧化钠与水反应产生NaOH和O2,1mol过氧化钠与水反应转移1mol电子,则78gNa2O2物质的量为1mol,则1mol Na2O2与足量水充分反应时电子转移数为NA,A正确;
B.2L 1mol/LNa2SO4溶液中硫酸钠的物质的量为2L×1mol/L=2mol,其中含有4mol钠离子和2mol硫酸根离子,共含有离子总数为6NA,B错误;
C.25℃、101.3kPa时,Vm≠22.4L/mol,不能按22.4L/mol计算氢气的分子数及原子数,C错误;
D. 4℃、101.3kPa时,54mL H2O质量为54g,物质的量为n(H2O)=![]() =3mol,含有的水分子数为3NA,D错误;
=3mol,含有的水分子数为3NA,D错误;
故合理选项是A。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,某同学设计了如图所示的实验装置(氯气易溶于CCl4,HCl不溶于CCl4)。
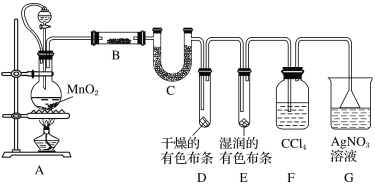
请回答下列问题:
(1)装置A中连接橡皮管的目的是___。
(2)装置A中发生反应的离子方程式为___。装置B中盛放的试剂是__。
(3)有同学基于实验的严谨性考虑,认为可在F、G两个装置之间再加一个装有湿润的淀粉KI试纸的装置,其目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。
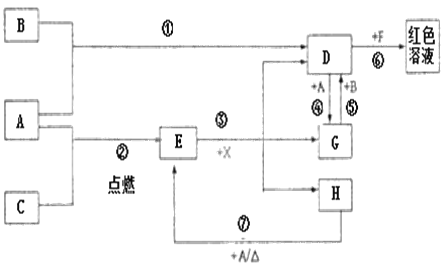
(1)写出下列物质的化学式:D___,X___。
(2)在反应①~⑦中,不属于氧化还原反应的是___(填数字编号)。
(3)反应⑥的离子方程式为:___。
(4)反应⑦的化学方程式为___;该反应中每消耗0.3mol的A,可转移电子___mol。
(5)除去D溶液中混有的少量G的方法是:___。
(6)检验G溶液中阳离子的方法是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月26日,中田首艘国产航母在大连正式下水,标志着我国自主设计航空母舰取得重大阶段性成果。请回答下列问题:
(1)航母用钢可由低硅生铁冶炼而成。
①硅原子L能层的电子分布图为____________________;
②Fe3+比Fe2+稳定的原因是_____________________;
③铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数为_________,与CN-互为等电子体的分子有__________(写出一种),铁氰化钾晶体中各种微粒间相互作用不包括_______________;
a. 离子键 b. 共价键 c.配位键 d. 金属键 e. 氢键 f. 范德华力
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

①M所含元素的电负性由大到小的顺序为__________(用元素符号表示);
②X中采用sp3杂化的非金属原子有___________(填写元素名称),采用sp3杂化的原子有__________个;
(3)Fe3O4是Fe3+、Fe2+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图所示,已知该晶体的晶胞参数为a nm,密度为b g/cm3,则NA=__________mol-1。(列出含a、b的计算式)
 (白球表示O2-)
(白球表示O2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组利用下图装置进行铁与水的反应的实验,并利用产物制取 FeCl36H2O 晶体。(图中的部 分装置略去)
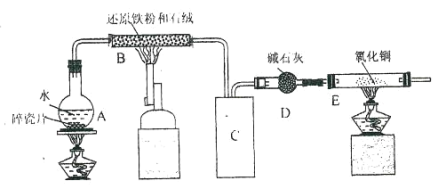
(1)A 中的碎瓷片的作用是_____,B 中发生反应的化学方程式为__________________。
(2)E 装置中的现象是_____。
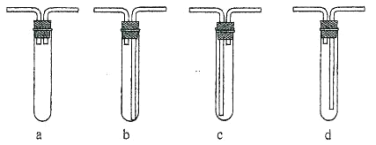
(3)C 装置应该是下列的(________)
(4)反应一段时间后,冷却并取出 B 中的固体,与过量的稀盐酸充分反应后(________)
(a)一定存在![]() (b)一定存在
(b)一定存在 ![]()
(c)可能存在![]() (d)
(d) ![]() 或
或![]() 只存在一种。
只存在一种。
(5)检验其中无![]() 的方法是_____。
的方法是_____。
(6)将上述溶液过滤:滤液![]() 溶液
溶液 ![]() 氯化铁晶体。步骤(I)通入 Cl2 的作用是_____,步骤(II)从较稀的溶液中得到晶体的主要操作包括_____,在此过程中保持盐酸稍过量的原因是_____。
氯化铁晶体。步骤(I)通入 Cl2 的作用是_____,步骤(II)从较稀的溶液中得到晶体的主要操作包括_____,在此过程中保持盐酸稍过量的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油![]() 即在汽油中添加一定量的甲醇
即在汽油中添加一定量的甲醇![]() ,根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体
,根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体![]() 一氧化碳
一氧化碳![]() 排放将近100万吨。甲醇常利用煤气化过程中生成的CO和
排放将近100万吨。甲醇常利用煤气化过程中生成的CO和![]() 来制备:CO+2H2
来制备:CO+2H2![]() CH3OH,
CH3OH,

请根据图示回答下列问题:
(1)关于该反应的下列说法中,正确的是______![]() 填字母
填字母![]() :
:
A.![]() ,
,![]()
![]() ,
,![]() C.
C.![]() ,
,![]()
![]() ,
,![]()
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和![]() ,净测得CO和
,净测得CO和![]() 的浓度随时间变化如图所示,从反应开始到平衡,CO的平均反应速率υ(CO)=______,该反应的平衡常数
的浓度随时间变化如图所示,从反应开始到平衡,CO的平均反应速率υ(CO)=______,该反应的平衡常数![]() ______。
______。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.υ生成(CH3OH)=υ消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
e. 混合气体的压强不再改变
(4)恒容条件下,达到平衡后,下列措施中能使![]() 增大的有______。
增大的有______。
A.升高温度 B.充入He气 C.再充入1molCO和![]() D.使用催化剂
D.使用催化剂
(5)若在一恒容的密闭容器中充入1molCO和![]() ,达到平衡时测的混合气体的压强是同温同压下起始的0.6倍(此过程三种物质均处于气态)则平衡时混合气体的平均摩尔质量
,达到平衡时测的混合气体的压强是同温同压下起始的0.6倍(此过程三种物质均处于气态)则平衡时混合气体的平均摩尔质量![]() ______
______![]() 。(结果保留3位有效数字)
。(结果保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com