
����Ŀ��A��B��CΪ��ѧ�������ʣ�����һ��Ϊ������ͨ�������AΪ���塢BΪ����ɫ���塢CΪ��ɫ���塣D��E��F��G��H��X��Ϊ���������X����������ɫ���壬��ˮ��Һ��һ������ǿ����Һ��EΪ��ɫ���壬H�ڳ�����ΪҺ�塣����֮���ת����ͼ��ʾ��ijЩ��Ӧ�����Ͳ��ַ�Ӧ��������ȥ����
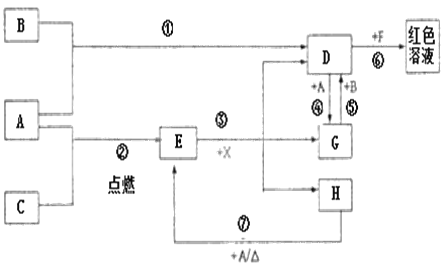
��1��д���������ʵĻ�ѧʽ��D___��X___��
��2���ڷ�Ӧ�١����У�������������ԭ��Ӧ����___�������ֱ�ţ���
��3����Ӧ�����ӷ���ʽΪ��___��
��4����Ӧ�ߵĻ�ѧ����ʽΪ___���÷�Ӧ��ÿ����0.3mol��A����ת�Ƶ���___mol��
��5����ȥD��Һ�л��е�����G�ķ����ǣ�___��
��6������G��Һ�������ӵķ����ǣ�___��
���𰸡�FeCl3 HCl �ۢ� Fe3++3SCN-=Fe(SCN)3 3Fe+4H2O(g)![]() Fe3O4+4H2 0.8 ����Һ��ͨ����������������ˮ�������������H2O2�� ȡ����G��Һ���Թ��У���2��KSCN��Һ����Һ����ɫ���ټ�������ˮ����Һ��Ϊ��ɫ
Fe3O4+4H2 0.8 ����Һ��ͨ����������������ˮ�������������H2O2�� ȡ����G��Һ���Թ��У���2��KSCN��Һ����Һ����ɫ���ټ�������ˮ����Һ��Ϊ��ɫ
��������
����A��C��Ӧ���ɺ�ɫ����E��E��X�ᷴӦ����D��G��H������D��G֮�����ʵ���ת����˵��AΪ��۽���Fe��EΪFe3O4��CΪO2������D+A=G˵��DΪ�����������ӵĻ����FΪ������������ӵĻ����GΪ��Fe2+���ӵĻ����H�ڳ�����ΪҺ�壬HΪH2O��BΪ����ɫ���壬B������������G+B=D�ж�DΪFeCl3��GΪFeCl2��XΪHCl���ݴ˽��
�������Ϸ�������1��D���Ȼ�������ѧʽ��FeCl3��X�����ᣬ��ѧʽ��HCl��
��2����Ӧ��������������Ӧ�����Ȼ�����Ԫ�ػ��ϼ۸ı䣬����������ԭ��Ӧ����Ӧ��������������Ӧ����Fe3O4��Ԫ�ػ��ϼ۸ı䣬����������ԭ��Ӧ����Ӧ����Fe3O4�����ᷴӦ����FeCl3��FeCl2��ˮ��Ԫ�ػ��ϼ۲��䣬������������ԭ��Ӧ����Ӧ����FeCl3������Ӧ����FeCl2����Ԫ�ػ��ϼ۸ı䣬����������ԭ��Ӧ����Ӧ����FeCl2��������Ӧ����FeCl3��Ԫ�ػ��ϼ۸ı䣬����������ԭ��Ӧ����Ӧ����Fe3+��SCN-��Ӧ����Fe(SCN)3��Ԫ�ػ��ϼ۲��䣬������������ԭ��Ӧ����Ӧ��������ˮ������Ӧ����Fe3O4��������Ԫ�ػ��ϼ۸ı䣬����������ԭ��Ӧ���ڷ�Ӧ�١����У�������������ԭ��Ӧ���Ǣۢޡ�
��3����Ӧ����Fe3+��SCN-��Ӧ����Fe(SCN)3�����ӷ���ʽΪFe3++3SCN-=Fe(SCN)3��
��4����Ӧ��������ˮ������Ӧ����Fe3O4����������ѧ����ʽΪ3Fe+4H2O(g)![]() Fe3O4+4H2��3mol����Ӧת��8mol���ӣ����Է�Ӧ��ÿ����0.3mol��������ת�Ƶ���0.8mol��
Fe3O4+4H2��3mol����Ӧת��8mol���ӣ����Է�Ӧ��ÿ����0.3mol��������ת�Ƶ���0.8mol��
��5��FeCl2��������Ӧ����FeCl3����ȥFeCl3��Һ�л��е�����FeCl2�ķ�����ͨ�������������
��6��Fe3+��SCN-��Ӧ����Ѫ��ɫFe(SCN)3��Fe2+��SCN-���ò��Ժ�ɫ�����Լ���Fe2+�ķ����ǣ�ȡ����G��Һ���Թ��У���2��KSCN��Һ����Һ����ɫ���ټ�������ˮ����Һ��Ϊ��ɫ��˵������Fe2+��


 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��������ͼ��ʾװ�ÿ�����ͭ�Ʊ�����һ�����������й�˵����ȷ����(����)

A.��Ƭ�缫�Ϸ�����ԭ��Ӧ���缫��ӦΪAg++e-=Ag
B.��Ӧ�����е���ȫ��ת��Ϊ��ѧ��
C.��ȥ��Դ�����ɻ�·����ͭ��������ʴ
D.�����һ��ʱ�����Դ���ӣ�ͭ�Ʋ����ָܻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪԭ������������������ֶ�����Ԫ�أ���֪C��DԪ�ص�ԭ������֮����A��BԪ�ص�ԭ������֮�͵�3������C��DԪ����ͬ����Ԫ�ء��ס��ҡ��������������ֶ�Ԫ�������������±���

���ʼ���ڷ�Ӧ����+��������B+������+��������D(����ɫ����)+��������˵����ȷ���ǣ� ��
A.�ס��ҡ������������Ϊֻ�����Լ��ļ��Է���
B.ԭ�Ӱ뾶��D>B>C���縺�ԣ�B>C>D
C.���þƾ�ϴ��ճ�������ڱ��ϵĵ���D
D.��2mol����3mol��ǡ�÷�Ӧ����2.5mol����B������Ϊ˫ԭ�ӷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������Ͽ�ѧ�ҷ������������ᾧˮ�ľ�����5K�³��ֳ����ԡ��þ���Ļ�ѧʽΪNa0.35CoO2��1.3H2O(�þ����Ħ������Ϊ122g��mol-1)������NA��ʾ�����ӵ���������12.2g�þ����к���ԭ����Ϊ___����ԭ�ӵ����ʵ���Ϊ___mol��
��2��FeCl3��Һ����������ˮ����100mL2mol��L-1��FeCl3��Һ��ˮʱ�����ɾ��о�ˮ���õ�����___(����ڡ������ڡ���С�ڡ�)0.2NA��
��3���ڱ�״���£�VLij����(Ħ������ΪMg/mol)�ܽ���1Lˮ(ˮ���ܶȽ���Ϊ1g/cm3)�У�����������ȫ�ܽ��Ҳ���ˮ������Ӧ��������Һ���ܶ�Ϊ��g/cm3����������Һ�����ʵ���Ũ��c=___mol/L(��������ĸ��ʾ���ұ��뻯��)��
��4����ҵ�����������ƺ�ϡ����Ϊԭ���Ʊ�ClO2��Ӧ��NaClO2��HCl��ClO2����NaCl+H2O��д����ƽ�Ļ�ѧ����ʽ____��
��5����100mL��FeBr2��Һ��ͨ���״����Cl23.36L(��֪��ԭ�ԣ�Fe2����Br��)����Ӧ�����Һ��Cl����Br�������ʵ���Ũ����ȣ���ԭFeBr2��Һ�����ʵ���Ũ��Ϊ____mol/L����Ӧ�����ӷ���ʽΪ____��
��6������ʢ��10mL1mol��L��1NH4Al(SO4)2��Һ���ձ��м�20mL1.2mol��L��1Ba(OH)2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ____mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2H2(g)��O2(g)===2H2O(g)����H����483.6kJ/mol��
��H2(g)��S(g)===H2S(g)����H����20.1kJ/mol�������ж�һ����ȷ����(����)
A. �ɢ�����֪��2H2S(g)��O2(g)===2S(g)��2H2O(g)�� ��H����443.4kJ/mol
B. �ɢ�֪��������ȼ����Ϊ241.8kJ
C. ��Ӧ���е������仯������ͼ��ʾ
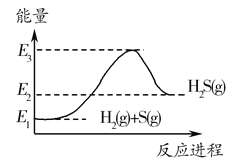
D. ����Ӧ���и��ù�̬������ȴ���20.1kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ѧ��Ӧ�е������仯�����ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ���¡���ͼΪN2(g)��O2(g)����NO(g)�����е������仯��

N2(g)��O2(g)����NO(g)�����е������仯
������ͨ���Ѳ�1molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ������N��N�ļ���Ϊ________kJ/mol��
������ͼд��N2(g)��O2(g)����NO(g)���Ȼ�ѧ����ʽ��___________________________
��2������֪��C(ʯī��s)��O2(g)===CO2(g) ��H1����393.5kJ/mol
2H2(g)��O2(g)===2H2O(l) ��H2����571.6kJ/mol
2C2H2(g)��5O2(g)===4CO2(g)��2H2O(l) ��H3����2599.2kJ/mol��
����C(ʯī��s)��H2(g)��Ӧ����1mol C2H2(g)ʱ��H��________kJ/mol��
�ڻ���ƽ�����ʢ��ǿ��ԭ��Һ̬����N2H4����ǿ������Һ̬˫��ˮ������0.4molҺ̬�º�0.8mol H2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�256.7kJ������(�൱��25����101 kPa�²�õ�����)����Ӧ���Ȼ�ѧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������(![]() )������Ϊ��ɫ�峺Һ�塣��Ҫ����������ά�ء���֬��һЩҩ����ܼ������л��ϳɵ��м��塣��������װ���Ʊ�̼���������
)������Ϊ��ɫ�峺Һ�塣��Ҫ����������ά�ء���֬��һЩҩ����ܼ������л��ϳɵ��м��塣��������װ���Ʊ�̼���������
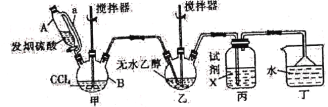
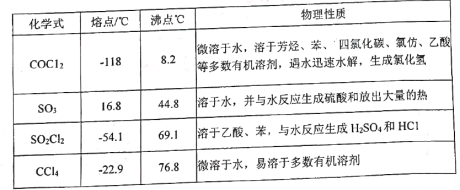
�ش��������⣺
(1)��װ����Ҫ�����Ʊ�����(COCl2)���Ƚ�����B�е����Ȼ�̼������55��60�����ٻ����μӷ������ᡣ
������B��������____________��������A�IJർ��a��������______________________��
(2)�Լ�X��____________����������_____________________________________________��
(3)��װ�ó�������COCl2�⣬�������յ�������____________(�ѧʽ)������B�����Ȼ�̼�뷢������(��SO3��ʾ)��Ӧֻ�����������ʵ���Ϊ1��1�IJ���Ҿ�����ˮ��Ӧ��д���÷�Ӧ��ѧ����ʽ��________________________________________________��
(4)��ˮ�Ҵ��������Ӧ�����ȼ����������ټ������Ҵ���Ӧ����̼���������
��д����ˮ�Ҵ��������Ӧ�����ȼ��������Ļ�ѧ����ʽ��__________________________��
������ʼͶ��92.0g��ˮ�Ҵ������յõ�̼�������94.4g����̼��������IJ�����______(��λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���ö�п��Ƥ�����������Ʊ���ˮ������п��ZnSO4��7H2O��
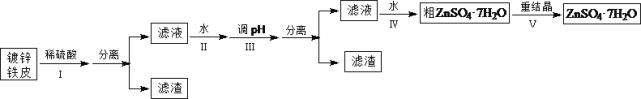
�����Ϣ���£��ٽ��������γ�����������������pH��Χ��
�������� | pH | |
��ʼ���� | ��ȫ���� | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
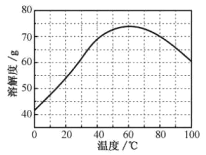
��ZnSO4���ܽ�ȣ�������100gˮ���ܽ�����������¶ȱ仯���ߡ�
��ش�
(1)�ٶ�п��Ƥ�ϵ����ۿ���Na2CO3��Һȥ����������_______________________________���ڲ���������ж϶�п����ȫ��Ӧ��ʵ��������_______________________________��
(2)�������������H2O2��������_______________________________��
(3)������ʵ�pH��Χ��_______________________________��
(4)���������Ҫ�õ���������������a.��������Һ���־�Ĥ��b.��60�������ܼ���c.��ȴ�����£�d.��100�������ܼ���e.���ˡ������������������ȷ˳��___________________���������ظ�ʹ�ã���
(5)�������ijͬѧ���ò�ͬ���·�ʽ������ȴ�ᾧ�����ZnSO4��7H2O���������С�ֲ���ͼ1��ʾ�����ݸ�ʵ������Ϊ�˵õ�������С��Ծ�һ�Ľϴ�������ѡ��_________��ʽ������ȴ�ᾧ��
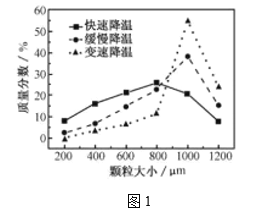
A.���ٽ��� B. �������� C.���ٽ���
(6)ZnSO4��7H2O��Ʒ�Ĵ��ȿ�����λ�ζ����ⶨ��
�� ���й��ڵζ���������ȷ����________________��
A.ͼ2�У�Ӧ����ʿ��Ϳ��������a�˺��������ڵ�c��

B.�ζ�ǰ����ƿ�͵ζ��ܾ����ñ���Һ��ϴ
C.������Һװ��ζ���ʱ��Ӧ�����ձ���©���Ȳ�������ת��
D.�ζ�ʱ��ͨ�������ֿ��������μ���Һ������ҡ����ƿ��ʹ��Һ��ͬһ������ת
E.�ζ�ǰ�ζ��ܼ����������ݣ��ζ�������������ݣ����õ������ʵ�����ĵ�С
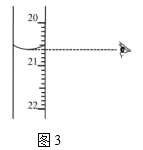
��ͼ3����ʾ�ζ��յ�ʱ�Ķ�����_____________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe2+��I-��Br-����Һ��ͨ������Cl2,��Һ�и������ӵ����ʵ����仯��ͼ��ʾ�������й�˵����ȷ����( )
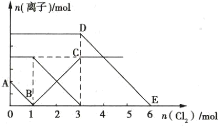
A.�߶�BC����Cl-���ʵ����ı仯���
B.ԭ�����Һ��c(FeBr2)=6mol��L-1
C.��ͨ��2mol Cl2ʱ,��Һ���ѷ��������ӷ�Ӧ�ɱ�ʾΪ2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.ԭ��Һ��n(Fe2+):n(I-):n(Br-)=2:2:3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com