
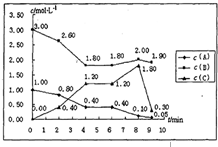
 在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示:
在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示:| 10 |
| 9 |
| 10 |
| 9 |
| △c |
| △t |
| c2(C) |
| c(A)?c2(B) |
| 0.4mol/L |
| 2min |
| 1.2mol/L-0.4mol/L |
| 4min-2min |
| c2(C) |
| c(A)?c2(B) |
| (1.2mol/L)2 |
| 0.4mol/L×(1.8mol/L)2 |
| 10 |
| 9 |
| 10 |
| 9 |
 2C(g)△H=-XkJ/mol
2C(g)△H=-XkJ/mol| 1mol |
| 0.6mol |
| XkJ |
| 235.92kJ |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南安阳一中高二奥赛班第二次阶段考试化学试卷(带解析) 题型:填空题
(4分)丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)写出表示丙烷气体燃烧热的热化学方程式
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)  CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则υ(H2)= ,此过程吸收的热量为_____________。
(3)对于反应CO(g) + H2O(g)  CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥υ(CO2)正=υ(H2O)逆
查看答案和解析>>
科目:高中化学 来源:2011年河南省南阳市内乡高中高考化学模拟试卷(四)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com