
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。减少CO2排放是一项重要课题。
(1)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120 ℃和催化剂条件下合成DMC。
已知:①CO(g) +1/2O2(g) === CO2(g) ΔH1=-283.0 kJ·mol-1
②H2O(l)===H2O(g) ΔH2=+44.0 kJ·mol-1
③2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH3=-15.5 kJ·mol-1
CH3OCOOCH3(g)+H2O(g) ΔH3=-15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g) ![]() CH3OCOOCH3(g)+H2O(l) ΔH=________。
CH3OCOOCH3(g)+H2O(l) ΔH=________。
(2)在2L的密闭容器中通入2 mol CH3OH和1 mol CO2,按反应③合成DMC,一定条件下,平衡时CO2的转化率如图所示,则:

①A点的平衡常数为_________________
②v(A)、v(B)、v(C)由快到慢的顺序为__________________;
③下列能说明在此条件下反应达到平衡状态的是________。
A.2v正(CH3OH)=v逆(CO2)
B.CH3OH与CO2的物质的量之比保持不变
C.恒容条件,容器内气体的密度保持不变
D.各组分的物质的量分数保持不变
(3)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol CO2和2 mol H2,测得有关物质的物质的量随温度变化如图所示。

①该催化剂在较低温度时主要选择________(填“反应Ⅰ”或“反应Ⅱ”)。
②用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图所示。b电极上的电极反应式为________________________________。

【答案】-342.5 kJ·mol-1 1 v(C)>v(B)>v(A) D 反应Ⅰ 2CO2+12H++12e-===C2H4+4H2O
【解析】
(1)目标反应可由![]() 得到,根据盖斯定律,所求反应的焓变为
得到,根据盖斯定律,所求反应的焓变为![]() ,
,
故答案为:-342.5 kJ·mol-1;
(2)①A点的转化率为50%,列三段式,
则A点的平衡常数为![]() ;
;
②该反应为气体分子数减少的反应,压强越大转化率越高,故![]() ,A、B两点温度相同,C点温度最高,故
,A、B两点温度相同,C点温度最高,故![]() ;
;
③A、![]() ,正逆反应速率不相等,故A错;
,正逆反应速率不相等,故A错;
B、因甲醇和二氧化碳的初始投料比为2:1,反应消耗也是2:1,故甲醇和二氧化碳的物质的量之比始终是2:1,故甲醇与二氧化碳的物质的量之比保持不变无法判断反应是否是平衡状态,B错;
C、恒容时,总体积不变,根据质量守恒,气体总质量保持不变,故气体密度始终不变,无法判断是否平衡状态,C错;
D、各组分的物质的量分数保持不变,说明各组分的量不再变化,说明反应达到了平衡状态,D正确;
故答案为:1;![]() ;D;
;D;
(3)①根据图像,在温度低的时候,生成![]() 比
比![]() 要多,该催化剂在较低温度时主要选择反应Ⅰ;
要多,该催化剂在较低温度时主要选择反应Ⅰ;
②b电极连接电源负极,为阴极,发生还原反应,二氧化碳在酸性环境中转化为![]() ,故电极反应式为:
,故电极反应式为:![]() ;
;
故答案为:反应Ⅰ;![]() 。
。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.64 g铜丝加热下在足量硫黄蒸气里完全反应后,失去的电子数为NA
B.0.2 mol NO和0.1 mol O2充分反应后,混合物的分子数为0.2NA
C.1 mol SO2溶于足量水,溶液中H2SO3、HSO3-与SO32-粒子的物质的量之和为NA
D.l00g质量分数为46%的乙醇水溶液中氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是重要的有机合成中间体,是重要的化工原料。己二酸的物理常数如表所示:
物质 | 色态 | 相对分子质量 | 熔点/℃ | 溶解度(性) | |||
g/100mL水 | 乙醇 | ||||||
己二酸 | 白色晶体 | 146 | 152 | 15℃ | 25℃ | 100℃ | 易溶 |
1.4 | 2.3 | 160 | |||||
Ⅰ.制备己二酸的一种反应机理如下:
![]() +HNO3(浓)
+HNO3(浓)![]() HOOC(CH2)4COOH+NO2↑+H2O(未配平)
HOOC(CH2)4COOH+NO2↑+H2O(未配平)
制备己二酸的装置如图所示(夹持、加热装置省略)。

(1)向三颈烧瓶中加入2mL浓HNO3,再缓慢滴加1mL环己醇,保持80℃持续反应2h。仪器b的名称是______________,能否用于蒸馏冷凝: ____________(填“能”或“否”)。反应结束冷却至室温后,在冰水浴中冷却,分离出己二酸粗品,用冰水浴的目的是__________
(2)图中装置的缺陷为____________________。
Ⅱ.用浓HNO3做氧化剂的合成方法中,浓HNO3会严重腐蚀设备。科学家改进了合成已二酸的方法,改进后的反应机理如下:
![]()
![]() HOOC(CH2)4COOH
HOOC(CH2)4COOH
(环己烯,难溶于水,易溶于乙醇),使用的装置如图所示(夹持、加热装置省略)。

(3)仪器c与a相比较,优点在于___________。
(4)检验己二酸粗产品中含有少量环己烯时的方法_________。
(5)实验结束后,准确称取实验产品0.1500g于250mL锥形瓶中,加入50mL热的蒸馏水,搅拌溶解,滴加几滴酚酞。用0.1000molL-1 NaOH溶液滴定。重复上述操作两次,消耗NaOH的平均体积为20.00mL。
①滴定终点的现象为__________。
②产品的纯度为______________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000 mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法不正确的是
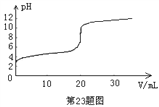
A. 在反应过程中,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
B. pH=5时,c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
C. pH=6时,c(Na+)+ c(H+)-c(OH-)+ c(CH3COOH)=0.1000 mol·Lˉ1
D. pH=7时,消耗NaOH溶液的体积小于20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有德国重离子研究中心人工合成的第 112 号元素的正式名称为“Copernicium”,相应的 元素符号位“Cn”。该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成 Cn 的过程可表示为:![]() Zn+
Zn+ ![]() Pb=
Pb=![]() Cn+
Cn+![]() n,下列叙述中正确的是
n,下列叙述中正确的是
A.![]() Cn 的原子核内中子数比质子数多 53
Cn 的原子核内中子数比质子数多 53
B.Cn 元素的相对原子质量为 277
C.上述合成过程中属于化学变化
D.Cn 元素位于元素周期表的第六周期,是副族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,利用海水可提取很多重要的化工原料。
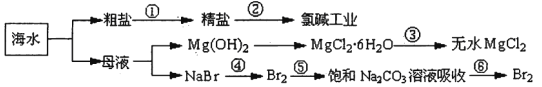
下列有关说法正确的是.( )。
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置
C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2
D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 、
、![]() 、
、![]() 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);△H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量,下列说法中不正确的是( )
2Z(g);△H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量,下列说法中不正确的是( )

A.t3时减小了压强B.t5时升高了温度
C.t2时加入了催化剂D.t4~t5时间内转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种轻金属,被称为金属界的“万金油”,应用范围极其广阔,含铝的化合物如氧化铝、氢氧化铝等在工业上用途十分广泛。
(1)写出金属铝与NaOH反应的化学方程式,并标出电子转移数目和方向: _______________________________________________________________________。
将一滴汞滴在已除去表面氧化膜的铝片上,放置在空气中等待片刻,滴在汞的地方会较快地长出“白毛”,其成分为_______________。
a. Al2O3 b . Al(OH)3 c. HgO d.铝汞齐
(2)某兴趣小组尝试分离Fe2O3和Al2O3的混合物,流程图,写出下列操作的名称及物质的化学式:
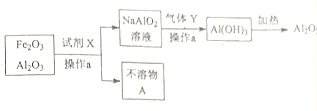
操作a的名称为_____________;
试剂X__________;不溶物A__________;
气体Y__________;
(3)写出Al(OH)3的电离方程式____________________________________________。实验室通常用AlCl3溶液作为制备Al(OH)3的原料,写出在![]() 溶液中滴加过量NaOH溶液的化学方程式:_________________________________________________。
溶液中滴加过量NaOH溶液的化学方程式:_________________________________________________。
(4)在100mL 2mol/L AlCl3溶液中滴加NaOH溶液,过滤、洗涤、烘干后得到7.8g Al(OH)3沉淀,则加入的NaOH的物质的量为__________mol。
(5)氢氧化铝是应用广泛的无机阻燃添加剂,阻燃时发生的化学反应为:2 Al(OH)3 ![]() Al2O3+3H2O根据方程式解释氢氧化铝能做阻燃剂的原因:_______________________________________________________________________。
Al2O3+3H2O根据方程式解释氢氧化铝能做阻燃剂的原因:_______________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com