
 xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬, ������0.8molD�������C��Ũ��Ϊ0.4mol��L������д���пհף�
xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬, ������0.8molD�������C��Ũ��Ϊ0.4mol��L������д���пհף�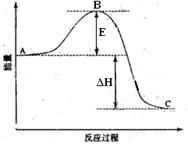 (6)���������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼ����C��D��4/3mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ���� ���� mol��
(6)���������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼ����C��D��4/3mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ���� ���� mol�� 2C(g)+2D(g)
2C(g)+2D(g)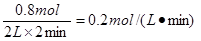



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 PCl3(g)��Cl2(g)
PCl3(g)��Cl2(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H= -90.8kJ��mol-1��
CH3OH(g) ��H= -90.8kJ��mol-1��| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO .2molH2 | 1mol CH3OH | 2molCO��4molH2 |
| CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1 kJ | ����Q2 kJ | �ų�Q3 kJ |
| ƽ�ⳣ�� | K1 | K2 | K3 |
| ��Ӧ��ת���� | �� 1 | �� 2 | �� 3 |
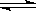 CH3OCH3��g��+CO2��g����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء�����ԭ��ʾ��ͼ��a�缫�ķ�ӦʽΪ
CH3OCH3��g��+CO2��g����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء�����ԭ��ʾ��ͼ��a�缫�ķ�ӦʽΪ �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C��g��+3D��g���ֱַ������;������ƽ�⣺I��A��B����ʼ����Ϊ2mol����C��D����ʼ���ֱ�Ϊ2mol��6mol��������������ȷ���ǣ� �� ��
C��g��+3D��g���ֱַ������;������ƽ�⣺I��A��B����ʼ����Ϊ2mol����C��D����ʼ���ֱ�Ϊ2mol��6mol��������������ȷ���ǣ� �� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
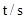 | 0 | 500 | 1000 |
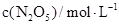 | 5.00 | 3.52 | 2.48 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
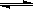 C��g��+D��g�����ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
C��g��+D��g�����ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺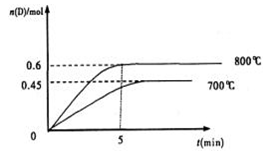
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Fe(s)+CO2(g)�� ?��H=a kJ/mol��a >0�������¶���K=0.263�������йظ÷�Ӧ��˵����ȷ����
Fe(s)+CO2(g)�� ?��H=a kJ/mol��a >0�������¶���K=0.263�������йظ÷�Ӧ��˵����ȷ����| A��������1 mol Fe�������յ�����С��a kJ |
| B���������¶ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ�������ѧƽ�������ƶ� |
| C����������ѹǿ����ʱ��仯��������жϸ÷�Ӧ�Ѵﵽ��ѧƽ��״̬ |
| D���ﵽ��ѧƽ��״̬ʱ����c(CO)="0.100" mol/L����c(CO2)="0.0263" mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g) ��H<0����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L���ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
2SO3(g) ��H<0����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L���ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
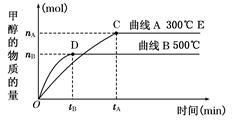
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com