
 2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断: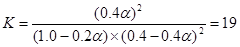 (3′)
(3′)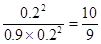 <19,所以该反应还没有达到平衡状态,此时正反应速率大于逆反应速率,因此反应向正反应方向进行。
<19,所以该反应还没有达到平衡状态,此时正反应速率大于逆反应速率,因此反应向正反应方向进行。 2SO3(g)
2SO3(g)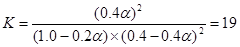 。
。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
 2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是| A.增大SO2的转化率K值一定增大 | B.减小压强K值减小 |
| C.升高温度K值增大 | D.K值越大SO2转化率越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白: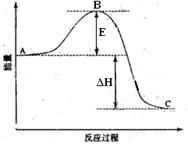 (6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是 (填字母)。
2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是 (填字母)。| A.升高温度 | B.降低温度 | C.加入O2 | D.减小压强 |
| 容器编号 | n(O2) | n(NO) | n (NO2) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②v正___v逆? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③v正___v逆? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)  2HI(g) ?H=-akJ?mol—1,实验条件和起始投料如下表所示,以下结论正确的是
2HI(g) ?H=-akJ?mol—1,实验条件和起始投料如下表所示,以下结论正确的是
| A.甲组中,若平衡时N2和NN3的转化率分别为α1 和α2,则α1 +α2=1 |
| B.乙组中,平衡Ⅱ中NH3的浓度是平衡Ⅰ的二倍 |
| C.丙组中,若达平衡时Ⅰ中放热Q1kJ, Ⅱ中吸热Q2kJ,则Q1+Q2=a |
| D.丁组中,达平衡所需时间:Ⅰ小于Ⅱ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于0.8 mol | B.等于1.6 mol |
| C.大于0.8 mol小于1.6 mol? | D.大于1.6 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 cC(g) + dD(g),△H="Q" kJ/mol,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如图所示,据图分析,以下正确的是
cC(g) + dD(g),△H="Q" kJ/mol,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如图所示,据图分析,以下正确的是
| A.T1>T2,Q>0 | B.Tl<T2,Q>0 |
| C.P1>P2,a+b=c+d | D.Pl<P2,b=c+d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com